题目内容
为测定黄铜(由锌、铜形成的合金)样品中铜的质量分数,往样品中加入稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如右图所示。

试计算:
(1)样品中铜的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】
35% 25%
【解析】(1)样品中铜的质量分数=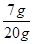 ×100%=35% ………………………(2分)
×100%=35% ………………………(2分)
(2)设反应生成的硫酸锌的质量为x,生成氢气的质量为y,由图可知样品中锌的质量为
20g-7g=13g………………………(1分)
Zn + H2SO4 = ZnSO4 + H2↑………………………(1分)
65 161 2
13g x y
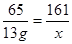 x=32.2g ……………………(2分)
x=32.2g ……………………(2分)
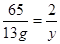 y=0.4g ……………………(2分)
y=0.4g ……………………(2分)
所得溶液中溶质的质量分数=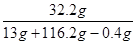 ×100%=25% …………(2分)答:(略)
×100%=25% …………(2分)答:(略)

练习册系列答案
相关题目
 (2012?贵港一模)为测定黄铜(由锌、铜形成的合金)样品中铜的质量分数,往样品中加入稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示.
(2012?贵港一模)为测定黄铜(由锌、铜形成的合金)样品中铜的质量分数,往样品中加入稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示.


