题目内容
13. 为测定空气里氧气的含量,甲、乙、三个同学用如图所示的装置分别进行了实验探究.
为测定空气里氧气的含量,甲、乙、三个同学用如图所示的装置分别进行了实验探究.(1)甲同学:点燃红磷立即伸入瓶中并塞上瓶塞.待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶容积的$\frac{1}{5}$.
(2)乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是碳燃烧生成物是二氧化碳气体,瓶内气压不变.
(3)甲同学进行的实验结束后,集气瓶中的水位上升小于$\frac{1}{5}$的原因可能有哪
些装置漏气,红磷量不足.
分析 根据测定空气中氧气的含量的原理是燃烧物消耗空气中的氧气,然后生成物几乎不占空间,从而造成气压差,则进入的水就是消耗的氧气的量进行分析;
解答 解:(1)因为红磷燃烧消耗空气中的氧气,氧气约占空气体积的$\frac{1}{5}$,故集气瓶中吸入水的体积约占集气瓶容积的$\frac{1}{5}$;
(2)测空气中氧气的含量主要是根据物质燃烧消耗空气中的气体造成气压减小,减小的体积就是氧气的体积,故生成物中不能有气体,用碳代替红磷,碳燃烧生成物是二氧化碳气体,瓶内气压不变,故不会进入水;
(3)根据在测定空气中氧气的体积分数时注意事项:装置的气密性要好;为了要耗尽瓶中的氧气,红磷必须是足量的;气体的体积受到温度的影响,要等到装置冷却至室温,再打开了弹簧夹等;因此可知达不到瓶中空气总体积的五分之一的原因可能是:装置漏气或红磷量不足或容器未冷却就打开止水夹.
答案:(1)$\frac{1}{5}$;(2)碳燃烧生成物是二氧化碳气体,瓶内气压不变.(3)装置漏气、红磷量不足.
点评 本考点考查了空气中氧气的含量的探究,并且注重了实验方案的评价,对实验方案进行评价是近几年中考的一个重点.评价包括对实验方案的评价、实验过程的评价、实验结论的评价等,要认真把握.

练习册系列答案
相关题目
3.下列关于空气成分的说法错误的是( )
| A. | 饼干在空气中变软是因为空气中含有水蒸气 | |
| B. | 稀有气体通电发光是化学变化 | |
| C. | 水中的生物能依靠微溶于水中的氧气而生存 | |
| D. | 氧气约占空气体积的21% |
4.下列对氮气的用途叙述不正确的是( )
| A. | 制造氮肥 | B. | 医疗上用作冷冻计 | ||
| C. | 制作各种电光源 | D. | 用作保护气 |
8.在人呼出气体和吸入气体的探究实验中,下列说法错误的是( )
| A. | 向两种气体中分别滴入等量的石灰水,比较二氧化碳含量的多少 | |
| B. | 向两种气体中分别伸入带火星的木条,比较氧气含量的多少 | |
| C. | 取两块玻璃片,对着一片呼气,比较水蒸气含量的多少 | |
| D. | 用排水法收集人呼出气体,将集气瓶正方在桌面上 |
18.下列关于水的说法不正确的是( )
| A. | 雨水、河水是软水,冰和雪是硬水 | |
| B. | 对天然水进行净化的各种处理中,净化程度最高的是蒸馏 | |
| C. | 自然界中的水大多属于混合物 | |
| D. | 我国人均淡水占有量只相当于世界人均淡水占有量的$\frac{1}{4}$ |
5.正确的实验操作对实验结果、人身安全非常重要.下列实验基本操作正确的是( )
| A. |  检查气密性 | B. |  点燃酒精灯 | C. |  塞紧橡皮塞 | D. |  滴加液体 |
1.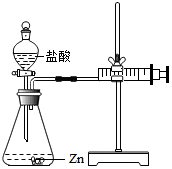 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应的剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关;
b.可能与盐酸的浓度有关.
【设计探究】实验所用金属均已用砂纸打磨
实验(1):为探究猜想a,小组同学分别在两支试管中放入相同质量的镁片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放镁片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,写出镁与稀盐酸发生反应的化学方程式Mg+2HCl=MgCl2+H2↑;从实验现象可判断:金属活动性Mg>Fe(填“<”“=”或“>”);
得出结论:金属与盐酸发生反应的剧烈程度与金属本身的性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积所用药品、实验数据如表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】
(注意:若答对本小题将奖励4分,但化学试卷总分不超过60分)
根据表中实验II数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响①温度;②金属表面积大小.(答两条即可)
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应的剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关;
b.可能与盐酸的浓度有关.
【设计探究】实验所用金属均已用砂纸打磨
实验(1):为探究猜想a,小组同学分别在两支试管中放入相同质量的镁片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放镁片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,写出镁与稀盐酸发生反应的化学方程式Mg+2HCl=MgCl2+H2↑;从实验现象可判断:金属活动性Mg>Fe(填“<”“=”或“>”);
得出结论:金属与盐酸发生反应的剧烈程度与金属本身的性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积所用药品、实验数据如表:
| 实验 编号 | 选用金属 (均取2g) | 盐酸浓度 (均取50 mL) | 每30秒产生气体的体积/mL | |||||
| 30秒 | 30~ 60秒 | 60~ 90秒 | 90~ 120秒 | 120~ 150秒 | 前150秒收 集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】
(注意:若答对本小题将奖励4分,但化学试卷总分不超过60分)
根据表中实验II数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响①温度;②金属表面积大小.(答两条即可)