题目内容
向装有等量水的A、B、C烧杯中分别加入10 g、
25 g、25 g NaNO3固体,充分溶解后,现象如图一所示。
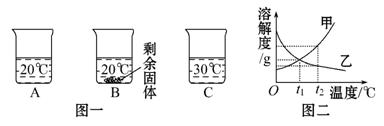
(1)烧杯中的溶液一定属于饱和溶液的是 (填序号);
(2)图二中能表示NaNO3溶解度曲线的是 (填“甲”或“乙”);
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是 ________;
(4)由图二分析,若分别将100 g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
(1)A、C中固体完全溶解不能判断是否是饱和溶液,B中固体有剩余,一定是饱和溶液。(2)由图一可以看出,NaNO3的溶解度随着温度的升高而增大,所以甲应该是NaNO3的溶解度曲线。(3)要使剩余的固体溶解,可以加水或升高温度。(4)由于乙的溶解度随着温度的降低而增大,所以从t2℃降到t1℃乙变成不饱和溶液,A叙述不正确;t2℃甲的溶解度比乙大,100 g饱和溶液中所含的溶质甲比乙多,则溶剂的量甲小于乙,从t2℃降到t1℃,溶液中溶剂的质量不变,B叙述是正确的;从t2℃降到t1℃,甲析出晶体,乙溶液质量不变,所以溶液的质量甲应小于乙,C叙述不正确;t2℃时甲的溶解度大于乙的溶解度。故该温度下甲饱和溶液溶质的质量分数大于乙饱和溶液溶质的质量分数,降温至t1℃时甲溶解度降低,析出晶体,为t1℃时饱和溶液,乙的溶解度增大,溶质质量分数不变。由于甲t1℃时的溶解度大于t2℃时乙的溶解度,故t1℃时甲的溶质质量分数大于乙的溶质质量分数。
答案:(1)B (2)甲 (3)加水(或升温) (4)B、D

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量.他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 .
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可).
把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示,下列说法正确的是( )
| 物质 | A | B | C | D |
| 反应前的质量/g | 19.7 | 8.7 | 21.6 | 0.4 |
| 反应后的质量/g | 待测 | 19.4 | 0 | 3.6 |
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7 g
C.反应中,物质B和物质D质量比为87:36
D.该反应为化合反应
 中除了含有CO2,还可能含有少量__________。实验室常用__________的方法检验这种可能含有的气体。
中除了含有CO2,还可能含有少量__________。实验室常用__________的方法检验这种可能含有的气体。
 钠,计算:
钠,计算: