题目内容
16.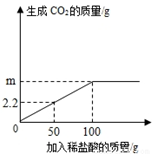 为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如图所示.
为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如图所示. (1)将石灰石样品研碎的目的是使碳酸钙反应完全.
(2)12.5g样品完全反应生成二氧化碳的质量m=4.4g.
(3)求该石灰石样品中碳酸钙的质量分数.
分析 (1)依据粉碎后物质间的接触更充分从而能促进反应物反应的更彻底分析解答;
(2)根据反应的盐酸的质量关系判断生成二氧化碳的质量即可;
(3)利用二氧化碳的质量结合反应的方程式求出碳酸钙的质量,即可求出石灰石样品中碳酸钙的质量分数.
解答 解:(1)由于石灰石样品研碎后碳酸钙和盐酸的接触面积变大,从而可以使碳酸钙反应完全;
(2)由图象可知50g盐酸可以生辰2.2g二氧化碳,则100g盐酸反应则会生成二氧化碳4.4g,故m=4.4g;
(3)设碳酸钙的质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
100
$\frac{100}{44}=\frac{x}{4.4g}$
x=10g
则该石灰石样品中碳酸钙的质量分数为$\frac{10g}{12.5g}$×100%=80%;
故答案为:(1)使碳酸钙反应完全;(2)4.4;(3)该石灰石样品中碳酸钙的质量分数为80%.
点评 准确判断图中刻度值是正确解决本题一个重要细节,因此正确判断生成二氧化碳质量是解题的关键.

练习册系列答案
相关题目
6.小林探究了影响物质溶解性的因素后.小林还认为:溶剂的多少也会影响物质溶解性.于是他进行相应的探究,请完成下列实验设计和问题交流.
【实验设计】
【问题交流】
(1)请你从控制变量角度优化步骤②向A烧杯倒入20克20℃的水,向B烧杯倒入60克20℃的水;
(2)步骤④需记录的是剩余食盐的质量;
(3)多次重复实验后,小林发现A、B两组在相同的条件下每10克水最多溶解食盐质量基本相同,于是得出结论:溶剂的多少不会影响物质溶解性.小红认为该实验还不具有普遍性.理由是加入水的质量相等.
【实验设计】
| 实验步骤 | 设计要求 |
| ①准备两个大小相同的烧杯,分别标为A、B;向两烧杯中分别倒入30克粗细相同的食盐. | 选择合适的实验器材 |
| ②向A烧杯倒入20克水,向B烧杯倒入60克水. | 设置对照实验 |
| ③都用玻璃棒充分搅拌直到A、B两烧杯底部的食盐不再溶解为止,过滤、干燥剩余食盐 | 控制实验条件 |
| ④称量并记录,并进行统计分析. | 观察和记录 |
(1)请你从控制变量角度优化步骤②向A烧杯倒入20克20℃的水,向B烧杯倒入60克20℃的水;
(2)步骤④需记录的是剩余食盐的质量;
(3)多次重复实验后,小林发现A、B两组在相同的条件下每10克水最多溶解食盐质量基本相同,于是得出结论:溶剂的多少不会影响物质溶解性.小红认为该实验还不具有普遍性.理由是加入水的质量相等.
7.某同学做实验时发现盛有NaOH溶液的试剂瓶口和橡胶塞上常有白色粉末出现.为了探究这种白色粉末的成分,设计如下实验,请你帮助完成实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 1、将白色粉末放于水中. | 白色粉末溶于水,形成无色溶液 | \ |
| 2、将无色酚酞滴入步骤1形成的无色溶液中. | 溶液颜色变红 | 该溶液呈碱性 |
| 3、在步骤2所形成的溶液中加入稀盐酸.并在试管口放一根燃烧的火柴. | 溶液由红色变成无色,燃烧的火柴熄灭了. | 溶液中含有碳酸根离子.白色粉末中含有氢氧化钠变质后生成的碳酸钠 |
4.提纯含少量泥沙的粗盐,一般经过如图所示的操作流程;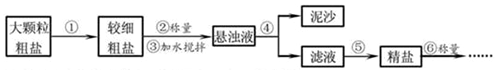
操作⑤中除了用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到蒸发皿、酒精灯等仪器.
实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是ABD(填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
根据氯化钠和硝酸钾在不同温度时的溶解度进行分析,要把硝酸钾从溶液中提取出来,采用的方法是降温结晶.

操作⑤中除了用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到蒸发皿、酒精灯等仪器.
实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是ABD(填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
根据氯化钠和硝酸钾在不同温度时的溶解度进行分析,要把硝酸钾从溶液中提取出来,采用的方法是降温结晶.
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
8.有一瓶无色气体失去了标签,某同学怀疑可能是二氧化碳.
(1)通过下列哪种方法能确定该气体是否为二氧化碳D
A上网查询 B讨论 C调查 D实验
(2)请你设计一个实验,证明这瓶气体就是二氧化碳,将实验操作、现象填在空格内:
(1)通过下列哪种方法能确定该气体是否为二氧化碳D
A上网查询 B讨论 C调查 D实验
(2)请你设计一个实验,证明这瓶气体就是二氧化碳,将实验操作、现象填在空格内:
| 实验操作 | 实验现象 | 实验结论 |
| 该气体是二氧化碳 |
5.在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,加入氯化钾的质量与得到相应溶液质量的关系如图所示,下列说法正确的是( )
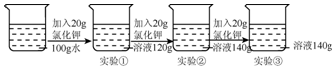

| A. | 该温度下氯化钾的溶解度是60g | |
| B. | 实验②所得溶液中溶质的质量分数为40% | |
| C. | 实验②和实验③所得溶液的浓度相同 | |
| D. | 实验①、②、③的溶液都是饱和溶液 |
6.对下列化学实验结果推测正确的是( )
| A. | 某无色溶液中滴加无色酚酞试剂显红色,该溶液一定是碱的水溶液 | |
| B. | 某溶液中滴加BaCl2,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42- | |
| C. | 验证某溶液中是否含有Cl-,先加AgNO3溶液,再加稀硝酸,若有白色沉淀生成,则证明该溶液中有Cl- | |
| D. | 某固体中加入稀盐酸,产生无色无味的气体,该固体中不一定含有CO32- |
 (1)构建知识网络是化学学习中重要的学习方法,小玲同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)构建知识网络是化学学习中重要的学习方法,小玲同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题: