题目内容
1.某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答: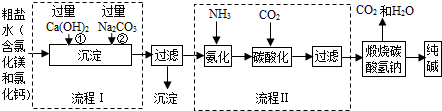
(1)流程Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么?不能颠倒,如果颠倒,过量的氢氧化钙和新生成的氯化钙无法除去,过滤的到的沉淀为氢氧化镁和碳酸钙.
(2)用一个化学反应方程式表示出流程Ⅱ中发生的总反应NaCl+H2O+NH3+CO2═NaHCO3+NH4Cl.
(3)请写出碳酸氢钠分解化学反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用是增大二氧化碳的吸收量.
(5)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是在该温度下碳酸氢钠的溶解度比氯化铵小.
分析 (1)根据碳酸钠的作用进行解答;根据氢氧化钙和氯化镁反应,碳酸钠和氯化钙反应进行解答;
(2)根据工业制纯碱的反应进行解答;
(3)根据碳酸氢钠受热分解生成物为碳酸钠、水和二氧化碳分析;
(4)根据氨气溶于水溶液显碱性,有利于二氧化碳的吸收进行解答;
(5)根据该温度下碳酸氢钠的溶解度比氯化铵小进行解答
解答 解:(1)流程图Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序不能颠倒,如果颠倒,过量的氢氧化钙和新生成的氯化钙无法除去;氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,碳酸钠和氯化钙反反应生成碳酸钙沉淀和氯化钠,过滤Ⅰ得到的沉淀成分有:氢氧化镁和碳酸钙;
(2)根据氯化钠、水、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,发生的总反应NaCl+H2O+NH3+CO2═NaHCO3+NH4Cl;
(3)碳酸氢钠受热分解生成物为碳酸钠、水和二氧化碳,化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)氨气溶于水溶液显碱性,有利于二氧化碳的吸收;
(5)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是在该温度下碳酸氢钠的溶解度比氯化铵小.
故答案为:(1)不能颠倒,如果颠倒,过量的氢氧化钙和新生成的氯化钙无法除去;氢氧化镁和碳酸钙;
(2)NaCl+H2O+NH3+CO2═NaHCO3+NH4Cl;
(3)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)增大二氧化碳的吸收量;
(5)在该温度下碳酸氢钠的溶解度比氯化铵小.
点评 本题考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.

| 项目 | 标准 |
| 感官指标 | 无异味、异臭等 |
| 化学指标 | pH6.5-8.5,铜<1.0mg•L-1,铁<0.3mg•L-1,氟化物<1.0mg•L-1,游离氯≥0.3mg•L-1等 |
(2)自来水属于混合物(填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是Cl-.
(5)检验水是硬水还是软水,可用的物质是肥皂水,生活中使硬水软化的常用方法是煮沸.

| 物质 | KCL | K2SO4 | NH4Cl | (NH4)2SO4 |
| 溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是CaCO3(填写化学式).
(3)反应③中相关物质的溶解度如表所示.反应③在常温下 能实现的原因是常温下K2SO4的溶解度小.
(4)洗涤反应③所得晶体不用水而用饱不用填和K2SO4溶液的目的是减少K2SO4的溶解;
检验此晶体是否洗涤干净的方法是可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净.
某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应,充分反应后再称取烧杯和剩余物质的总质量,实验小组做了三次实验,数据如下:
| 物质的质量 | |
| 反应前:烧杯+盐酸 | 22g |
| 10片钙片 | 8g |
| 反应后:烧杯+剩余物 | 27.8g |
(1)每片此钙片含碳酸钙的质量.
(2)每片钙片中钙元素的质量分数?

