题目内容
1. 海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.
海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.(1)海水晒盐.2015年我国海盐年产量高达5797万吨,居世界第一位.目前从海水中提取食盐的方法主要为“盐田法”.在蒸发池中促进水分蒸发的过程中,主要利用了下列各项中的(填选项序号)③.
①潮汐能 ②生物能 ③太阳能 ④化学能
(2)海水制“碱”.我国化学家侯德榜创立的“侯氏制碱法”,就是以海水“晒盐”得到的氯化钠为原料制得NaHCO3,再将NaHCO3稍加热即分解得到纯碱,其生产过程如图所示.

通过过程②可得到碳酸氢钠,化学方程式为NaCl+NH4HCO3═NaHCO3+X.请写出X的化学式NH4Cl,此反应属于复分解反应(选填”化合””分解“”复分解“”氧化“”置换“之一)
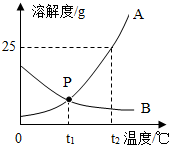
(3)如图是A、B两种物质的溶解度曲线.回答下列问题:
①t2℃时,A的溶解度为25g.图中P点的意义为在t1℃时AB的溶解度相等.
②t2℃时,AB饱和溶液溶质的质量分数为A>B.(选填“>““=““<“之一)
③将A和B的饱和溶液分别由t2℃降温到t1℃时(假设溶剂质量不变).请判断它们溶液中溶质的质量分数如何变化?简要写出理由A的溶质质量分数减小,B的溶质质量分数不变;降温时,A物质的溶解度减小,它的饱和溶液中析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小;B物质的溶解度增大,它的饱和溶液变为不饱和溶液,不析出晶体,溶质质量分数不变.
分析 (1)根据太阳能是取之不尽用之不竭的清洁能源进行分析;
(2)根据反应前后原子的种类和数量不变解答;
(3)根据已有的饱和溶液的形成、溶解度曲线的意义进行分析解答即可.
解答 解:(1)太阳能是取之不尽用之不竭的清洁能源,所以在蒸发池中促进水分蒸发,主要是利用了太阳能,故选:③;
(2)根据化学反应前后原子种类和数目不变,反应前各物质中N、H、C、O、Na、Cl元素的原子个数为:N 1,H 5,C 1,O 3,Na 1,Cl 1;而反应后NaHCO3的原子个数为:Na 1,H 1,C 1,O 3;则反应物X的一个分子中含有1个N原子、4个H原子和1个Cl原子,化学式为:NH4Cl,该反应属于复分解反应;
(3)①t2℃时,A的溶解度为25g,P点表示在t1℃时A、B的溶解度相等(t1℃时AB两饱和溶液的溶质质量分数相等);
②t2℃时,A物质的溶解度大于B物质的溶解度,所以A、B饱和溶液溶质的质量分数为A>B;
③将A和B的饱和溶液,由t2℃降温到t1℃时(假设溶剂质量不变),A的溶质质量分数减小,B的溶质质量分数不变;降温时,A物质的溶解度减小,它的饱和溶液中析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小;B物质的溶解度增大,它的饱和溶液变为不饱和溶液,不析出晶体,溶质质量分数不变.
故答案为:(1)③;
(2)NH4Cl,复分解;
(3)①25g,在t1℃时,A、B的溶解度相等;
②>;
③A的溶质质量分数减小,B的溶质质量分数不变;降温时,A物质的溶解度减小,它的饱和溶液中析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小;B物质的溶解度增大,它的饱和溶液变为不饱和溶液,不析出晶体,溶质质量分数不变.
点评 本题主要考查了海水综合利用的知识,难度不大,需要找准考查的知识点,即可正确解答.

 阅读快车系列答案
阅读快车系列答案| A. | 铜用于制造导线 | B. | 粉笔用于写字 | ||
| C. | 生铁铸造铁锅 | D. | 氧气用于急救病人 |
| A. | H2SiO3 | B. | Si(OH)4 | C. | NaHSiO4 | D. | Na2SiO3 |

 A~H都是初中化学中常见的物质,已知B为黑色固体,且A、D、G为单质,B、C、E、F为氧化物,它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知B为黑色固体,且A、D、G为单质,B、C、E、F为氧化物,它们的转化关系如图所示.请回答: