题目内容
9.“黄铜”是铜锌合金,具有较好机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取10.0g某种黄铜投入50g某稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为59.9g.请计算:(1)产生氢气的质量为0.1g.
(2)这种黄铜中铜的质量分数是多少?
(3)剩余溶液中溶质的质量分数是多少?(结果精确到0.1%)
分析 (1)因为反应中有氢气生成,所以反应后烧杯中物质的总质量会减少,而且总质量的减少量就是生成氢气的质量;
(2)因为铜锌合金中只有锌和稀硫酸反应,所以可根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到锌的质量,从而得到铜的质量,然后再求出铜的质量分数;
(3)根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到反应后溶质硫酸锌的质量,然后再计算出反应后溶液的质量,最后根据溶质质量分数的公式,得到溶液中溶质的质量分数.
解答 解:(1)产生氢气的质量=50.0g+10.0g-59.9g=0.1g
(2)设锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.1g
$\frac{65}{x}=\frac{161}{y}=\frac{2}{0.1g}$
解得:x=3.25g y=8.05g
所以铜的质量为:10.0g-3.25=6.75g
所以黄铜中铜的质量分数为:$\frac{6.75g}{10g}$×100%=67.5%
(3)反应后溶液的质量为:59.9g-6.75g=53.15g
所以反应后溶液中溶质的质量分数为:$\frac{8.05g}{53.15g}$×100%=15.1%
答:(1)产生氢气的质量为0.1g;
(2)这种黄铜中铜的质量分数为67.5%;
(3)反应后溶液中溶质的质量分数是15.1%.
点评 此题是利用化学方程式和溶质质量分数相结合的计算题,用反应后总质量的减少量来求反应生成气体的质量是此类题常用的方法,此题虽步骤较多,但解题思路清晰,计算并不复杂,属于中等难度的题目.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
20.在实验室用CO还原赤铁矿(主要成分是Fe2O3),下面说法不正确的是( )
| A. | 实验开始前要先通入CO,再加热 | |
| B. | 实验过程中观察到玻璃管内红色粉末逐渐变黑,澄清石灰水变浑浊 | |
| C. | 实验结束后要先停止通入CO,再停止加热 | |
| D. | CO具有还原性,H2、C也具有还原性 |
17.某物质具有如下性质,滴入无色酚酞变红,滴入氯化铜产生蓝色沉淀,加入碳酸钠溶液产生白色沉淀,则该物质是( )
| A. | KOH | B. | Mg(OH)2 | C. | CuSO4 | D. | Ca(OH)2 |
4.下列各组物质中能相互反应且属于复分解反应的是( )
| A. | 氢氧化镁和稀盐酸 | B. | 二氧化碳和石灰水 | ||
| C. | 氯化钾溶液和硝酸钠溶液 | D. | 锌和硫酸 |
14.除去如表物质中所含少量杂质的方法,不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | H2 | HCl | 将气体通过NaOH溶液,干燥 |
| B | FeCl2 | CuCl2 | 加入过量的铁粉,过滤 |
| C | MnO2 | KCl | 加足量水溶解,过滤、洗涤,干燥 |
| D | CaO | CaCO3 | 加足量水溶解,过滤、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
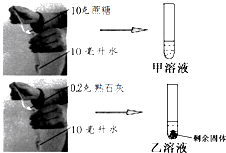 小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知:
小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知: