题目内容
【题目】(1)现有以下常见的物质:A 淀粉B 小苏打C 稀盐酸D 活性炭E 石灰石。请按要求填空(填字母):能吸附冰箱的异味的是_______;遇碘水变蓝色的是_______;蒸馒头时常用到的物质是_______;可用于金属表面除锈的是______。
(2)请用化学知识回答:
①用石灰浆粉刷墙壁后的室内放置一燃烧的煤炉,可使墙壁迅速硬化,同时墙壁上会出现一些水珠,其原因是(用化学方程式表示)___________。
②物质的组成与结构决定物质的性质,金刚石和石墨性质不同是由于金刚石和石墨的_____________________________不同。
③为防止菜刀生锈,下列做法可行的是___________(选填序号)
A 菜刀使用后用干抹布擦干
B 菜刀使用后涂植物油
C 菜刀使用后用盐水浸泡
【答案】D A B C ![]() 碳原子排列不同 AB
碳原子排列不同 AB
【解析】
(1)活性炭具有吸附性,可以吸附冰箱中的异味,故选D;
淀粉遇碘变蓝,故能使碘水变蓝的是:A;
碳酸氢钠加热会生成二氧化碳,碳酸氢钠也能和发酵过程中产生的酸性物质反应生成二氧化碳,故蒸馒头时常用到的物质是:B;
铁锈的主要成分是三氧化二铁,稀盐酸能与三氧化二铁反应生成氯化铁和水,故可用于金属表面除锈的是C;
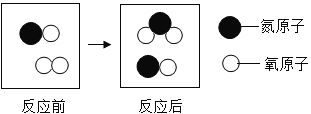
(2)①氢氧化钙能与煤燃烧产生的二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;
;
②金刚石和石墨性质不同是由于金刚石和石墨的碳原子排列方式不同;
③铁生锈的条件是铁与氧气、水接触,故为防止菜刀生锈,菜刀使用后可用干抹布擦干,或菜刀使用后涂植物油,均可达到防锈的目的,而用盐水浸泡则会加快菜刀生锈。
故选AB。

【题目】某化学学习小组为了测定某混合物(Na2CO3 与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液,充分反应,在此过程中他进行了三次数据测定,结果如下表:
测定次数 | 第1次 | 第2次 | 第3次 |
加入BaCl2溶液的质量/g | 60 | 120 | 150 |
生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
请分析数据,回答下列问题:
(1)第1次实验后所得溶液中溶质为_________;
(2)求样品中碳酸钠的质量分数____________(写出计算过程)。
【题目】小明在收拾实验室时发现有一瓶没有盖瓶盖的氢氧化钙固体,报告老师后,老师告诉同学们这瓶固体可能已经变质了。于是小明和小组的同学们一起探究这瓶久置于空气中的氢氧化钙固体的成分。
(提出问题):久置于空气中的氢氧化钙固体的成分?
(猜 想):猜想 1:氢氧化钙 猜想 2:碳酸钙 猜想 3:_______
(实验验证):
实验步骤 | 实验现象 | 实验结论 |
(1)取少量固体样品于试管中,加入一定的水振荡,静置 | ||
(2)取步骤(1)中的上层清液,滴加 2-3 滴无色酚酞试液,振荡 | ______ | 样品中含有氢氧化钙 |
(3)往上面试管中的剩余固体中倒入足量的稀盐酸 | ______ | 样品中含有碳酸钙 |
(得出结论):猜想 3 正确
(实验反思):上述实验中产生气泡的化学方程式为:______
(拓展提升):进一步探究这瓶氢氧化钙固体的变质程度,计算固体样品中氢氧化钙的质量分数?
(实验设计):小明和同学们设计了如下图所示的实验装置来测定样品中氢氧化钙的质量分数(铁架台、 铁夹等在图中均已省略)
(资料):饱和碳酸氢钠溶液可以吸收盐酸挥发出来的 HCl 气体;碱石灰为 NaOH 和 CaO 的混合物;装置 F 用于吸收空气的气体
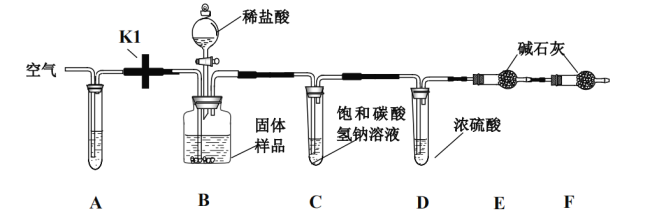
(实验步骤):
①准确称量 10.0g 固体样品装入装置 B
②将装置 B 分别与 A、C、D 连接,打开开关 K1,从 A 处鼓入空气,几分钟后,将开关 K1 关闭,再将已 称量过的干燥管 E、F 与 D 连接
③打开 B 中分液漏斗的活塞,再向 B 中缓缓的注入足量的稀盐酸
④待完全反应后,再次打开开关 K 缓缓鼓入空气几分钟,最后称量干燥管 E,增重 1.1g
(实验分析)
(1)已知装置 A 中试剂为某种碱性溶液,其作用是为了吸收空气中的某气体,写出吸收该气体所发生的
化学反应方程式:______________,实验前第一次鼓入空气是为了驱赶装置中的该气体,若反应后不鼓入空气,对测定结果的影响是_____________(填“偏大”或“偏小”)
(2)D 装置的作用是_____。
(3)根据干燥管 E 增加的质量,可推算出样品中氢氧化钙的质量分数为_______。
(4)实验结束后,同学们认为反应后的酸性废液不能直接进行排放,应该进行处理以后再排放,正确的处理方法是加入过量的______
A 熟石灰 B 碳酸钙 C 生石灰 D 氢氧化钠