题目内容
双氧水和二氧化锰的混合物共a g,完全反应后得到b g氧气和c g水,则混合物中二氧化锰的质量为( )
A.(a+b-c)g B.(a-b-c)g C.(a+b+c)g D.(a-c)g
【答案】
B
【解析】试题分析:根据质量守恒定律可知,参加反应的各物质质量总和等于生成物的各物质质量总和。结合反应的文字表达式 可知,生成氧气与水的质量之和等于反应的双氧水的质量,则双氧水的质量=bg+cg,所以二氧化锰的质量=ag-(bg+cg)=(a-b-c)g。故选B
可知,生成氧气与水的质量之和等于反应的双氧水的质量,则双氧水的质量=bg+cg,所以二氧化锰的质量=ag-(bg+cg)=(a-b-c)g。故选B
考点:本题考查质量守恒定律及其应用
点评:解题的关键是对质量守恒定律的应用时的物质质量关系的理解与掌握。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室常用下列装置来制取氧气:
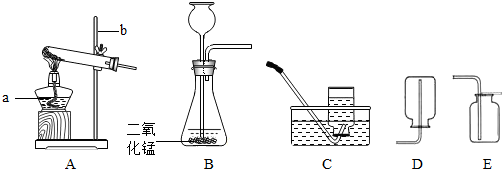
(1)写出图中有标号仪器的名称:a 、b ;
(2)用氯酸钾制取氧气时,发生反应的文字表达式为 .
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生装置是 ,收集装置是 .
(4)用E装置收集氧气时,检验氧气是否集满的方法是 .
(5)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),其中二氧化锰
起 作用,该反应的文字表达式为 .对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
请你分析表中数据并回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想: .

(1)写出图中有标号仪器的名称:a
(2)用氯酸钾制取氧气时,发生反应的文字表达式为
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生装置是
(4)用E装置收集氧气时,检验氧气是否集满的方法是
(5)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是
起
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰( MnO2 )粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:


