题目内容
12.下列归纳全部正确的是( )| A、实验记录 | B、生活化学 |
| ①用量筒量取7.25毫升水 ②用托盘天平称取9.76g的NaCl固体 | ①将硝酸铵溶于水制作“冷敷包” ②人体缺锌易导致侏儒症 |
| C、解释说明 | D、化学原理 |
| ①稀有气体作保护气,因为其化学性质稳定 ②波尔多液不能用铁桶盛放,因为其含有CuSO4 | ①酸雨形成的原因 CO2+H2O=H2CO3 ②铝制品耐腐的原因 4Al+3O2=2Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据量筒测量和天平的准确值考虑;
B、根据硝酸铵溶于水吸热、元素与人体健康的关系、缺乏症分析判断;
C、根据稀有气体化学性质稳定、铁与硫酸铜反应来分析;
D、根据酸雨形成的原因、铝表面被氧气氧化成氧化铝进行分析.
解答 解:A、量筒只能准确到0.1mL,不能用量筒量取7.25毫升水,错误;天平能准确到0.1g,不能用托盘天平称取9.76g的NaCl固体,错误;故A归纳错误;
B、硝酸铵溶于水吸热,温度会降低,可以用来制冷敷袋,正确;缺锌会使生长发育缓慢,智力低下,严重的会导致侏儒,正确;故B归纳全部正确;
C、稀有气体化学性质稳定,常可用作保护气,正确;农药波尔多液的成分之一是CuSO4,铁能与硫酸铜溶液反应生成硫酸亚铁和铜,正确;故C归纳全部正确;
D、二氧化硫与氮的氧化物能与水反应,生成硫酸、硝酸,溶液呈酸性,是造成酸雨的主要气体,二氧化硫形成酸雨的化学方程式可表示为:2SO2+2H2O+O2=2H2SO4;铝制品耐腐的原因:4Al+3O2═2Al2O3,正确;故D归纳不完全正确.
故选BC.
点评 化学来源于生产生活,也必须服务于生产生活,所以要用已有知识分析解决实际生活中具体问题.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
3.化学--我们的生活,我们的未来.下列物质在生活中的应用,合理的是( )
| A. | 用甲醛溶液浸泡海产品保鲜 | B. | 用食醋除去暖水瓶中的少量水垢 | ||
| C. | 用熟石灰改良酸性土壤 | D. | 可用氢氧化钠治疗胃酸过多症 |
7.氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙.
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置: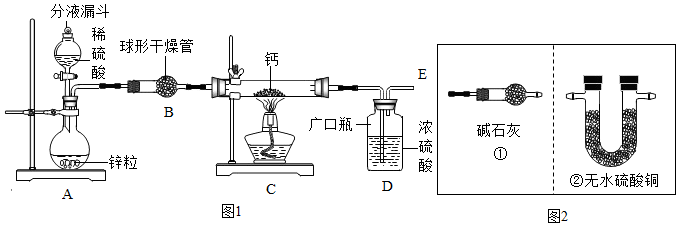
请回答:
①装置A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;为了实验安全,点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的②(选填:①或②)装置;
③图1装置D中浓硫酸的作用是防止空气中的水蒸汽进入C中;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数.
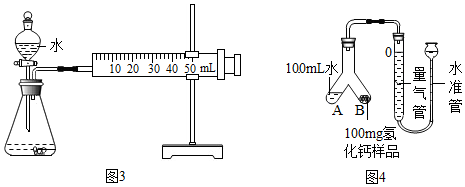
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在a时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为66.3%;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置:

请回答:
①装置A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;为了实验安全,点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的②(选填:①或②)装置;
③图1装置D中浓硫酸的作用是防止空气中的水蒸汽进入C中;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
| 实验步骤 | 预期现象和结论 |
| 取少量固体样品,在干燥条件下与氧气反应,将 其产物通入装有无水硫酸铜的干燥管; | 若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙 |

①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在a时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为66.3%;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
2.下列物质的应用正确的是( )
| A. |  食品袋内填充稀有气体防腐 | B. |  医疗急救时用纯氧 | ||
| C. |  金属钛制人造骨骼 | D. |  石灰水涂刷树木防害虫生卵 |

 图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.
图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线. 如图中的物质为初中化学常见物质,他们之间的反应关系如图所示(“→”表示转化关系,“-”表示相互能反应,部分反应物、生成物或反应条件已略去).
如图中的物质为初中化学常见物质,他们之间的反应关系如图所示(“→”表示转化关系,“-”表示相互能反应,部分反应物、生成物或反应条件已略去).