题目内容
15.某课外活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐.该小组的同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,并对料浆澄清液(“滤液”)的主要成分进行探究.【提出问题】料液的主要成分(H2O除外)是什么?
【关于料液的猜想】
小东认为:滤液中含有NaCl、Na2CO3、Ca(OH)2
小西认为:滤液中含有NaCl、NaOH、Na2CO3
小南认为:滤液中含有NaCl、NaOH、Ca(OH)2
小北认为:滤液中含有NaCl、NaOH
(1)大家讨论后一致认为小东的猜想一定不成立,理由是(用化学方程式表示)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
【设计实验探究】

(2)根据实验①可知小南的猜想不成立,根据实验③可知小西的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是盐酸的量太少,无法确定Na2CO3(溶液)是否存在.
【应用拓展】
(3)松花蛋味道鲜美,但直接食用会稍有涩味.如果将松花皮蛋蘸上食醋食用,则轻微涩味会被去除,味道变得更为鲜美可口.请你说明食醋可以去除松花皮蛋涩味的原因食醋中的酸(或醋酸)中和残留在皮蛋中的碱.
(4)现在有的皮蛋厂直接用烧碱(NaOH)代替生石灰和纯碱,但制得的皮蛋口感却不鲜美.烧碱一定要密封保存,其理由是AB(选序号填空).
A.烧碱易吸水潮解 B.烧碱易吸收空气中的CO2而变质
C.烧碱具有强腐蚀性 D.烧碱溶于水时放出热量
(5)假设小西的猜想是合理的,只用稀盐酸对废水进行处理,回收氯化钠溶液.操作及判断反应完全的方法为边滴加稀盐酸边搅拌,至恰好不再有气泡冒出.
分析 实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,一致认为小东的猜想一定不成立,理由是碳酸钠与氢氧化钙不能共存;由流程图可知:通入二氧化碳气体,没有白色沉淀,说明没有氢氧化钙,因此小楠的猜想不成立;通过实验②无法判断小西的猜想能否成立,理由是:盐酸的量太少,无法确定Na2CO3(溶液)是否存在;通过实验③加入足量的氯化钙溶液,有白色沉淀,说明有碳酸钠;静止后加入酚酞试液变红色,说明一定有氢氧化钠,因此小西的猜想是正确的.食醋可以去除松花皮蛋涩味的原因是:食醋中的酸(或醋酸)中和残留在皮蛋中的碱;烧碱一定要密封保存,其理由是:烧碱易吸水潮解,烧碱易吸收空气中的CO2而变质;小西的猜想是滤液中含有NaCl、NaOH、Na2CO3,只用稀盐酸对废水进行处理,回收氯化钠溶液,操作及判断反应完全的方法为:边滴加稀盐酸边搅拌,至恰好不再有气泡冒出.
解答 解:(1)本题通过实验资料和实验分析,一致认为小东的猜想一定不成立,理由是碳酸钠与氢氧化钙不能共存;故答案为:小东;Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
(2)由流程图可知:通入二氧化碳气体,没有白色沉淀,说明没有氢氧化钙,因此小楠的猜想不成立;通过实验②无法判断小西的猜想能否成立,理由是:盐酸的量太少,无法确定Na2CO3(溶液)是否存在;通过实验③加入足量的氯化钙溶液,有白色沉淀,说明有碳酸钠;静止后加入酚酞试液变红色,说明一定有氢氧化钠,因此小西的猜想是正确的;故答案为:小南 小西 盐酸的量太少,无法确定Na2CO3(溶液)是否存在.
(3)食醋可以去除松花皮蛋涩味的原因是:食醋中的酸(或醋酸)中和残留在皮蛋中的碱;故答案为:食醋中的酸(或醋酸)中和残留在皮蛋中的碱;
(4)烧碱一定要密封保存,其理由是:烧碱易吸水潮解,烧碱易吸收空气中的CO2而变质;故答案为:A、B,
(5)小西的猜想是滤液中含有NaCl、NaOH、Na2CO3,只用稀盐酸对废水进行处理,回收氯化钠溶液,操作及判断反应完全的方法为:边滴加稀盐酸边搅拌,至恰好不再有气泡冒出;故答案为:边滴加稀盐酸边搅拌,至恰好不再有气泡冒出;
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

| A. | 用燃着的木条区别二氧化碳和氮气 | |
| B. | 用水可以区别出粉末状二氧化锰和氧化铜 | |
| C. | 向鸡蛋清中滴加少量稀盐酸并微热以检验蛋白质的存在 | |
| D. | 用高锰酸钾溶液来检测二氧化碳中是否含有二氧化硫气体 |
| A. | 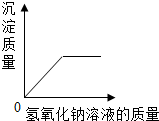 表示向一定量硫酸铜和硫酸混合液中加入氢氧化钠溶液 表示向一定量硫酸铜和硫酸混合液中加入氢氧化钠溶液 | |
| B. | 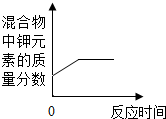 表示加热一定量氯酸钾和二氧化锰的混合物 表示加热一定量氯酸钾和二氧化锰的混合物 | |
| C. | 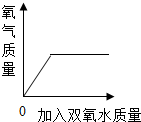 表示向盛有少量二氧化锰的烧杯中不断加入双氧水 表示向盛有少量二氧化锰的烧杯中不断加入双氧水 | |
| D. | 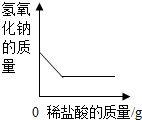 表示向一定量氢氧化钠溶液中加入稀盐酸 表示向一定量氢氧化钠溶液中加入稀盐酸 |
| A. | 红磷在氧气中燃烧产生白雾 | |
| B. | 硫在氧气中燃烧产生淡蓝色火焰 | |
| C. | 木炭在氧气中燃烧生成二氧化碳 | |
| D. | 铁丝在氧气中燃烧火星四射,生成黑色固体 |
 ,其中X=1,该原子在化学反应中易失电子,形成的粒子名称为钠离子,该粒子与氧离子构成的化合物的化学式为Na2O.
,其中X=1,该原子在化学反应中易失电子,形成的粒子名称为钠离子,该粒子与氧离子构成的化合物的化学式为Na2O.

