题目内容
现有一定量的粗盐,除含NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质,要除去杂质得到精盐,设计了下列实验方案(序号①-⑥表示实验操作步骤,所加的试剂均过量):
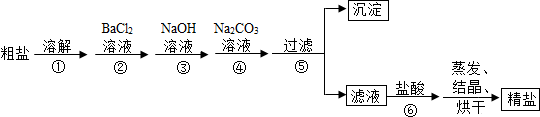
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是 .
(2)写出操作②中发生反应的反应式 ;写出操作③中发生反应的反应式 ,操作④中加入Na2CO3溶液的目的是 .

根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是
(2)写出操作②中发生反应的反应式
考点:氯化钠与粗盐提纯,物质的溶解,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:溶解时,利用玻璃棒搅拌可以加快溶溶解速率;
加入氯化钡溶液时,氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入氢氧化钠溶液时,氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液时,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,能和过量的氯化钡反应生成碳酸钡沉淀和氯化钠,加入稀盐酸时,能和过量的碳酸钠、氢氧化钠反应,最后得到氯化钠溶液.
加入氯化钡溶液时,氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入氢氧化钠溶液时,氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液时,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,能和过量的氯化钡反应生成碳酸钡沉淀和氯化钠,加入稀盐酸时,能和过量的碳酸钠、氢氧化钠反应,最后得到氯化钠溶液.
解答:解:(1)操作①中玻璃棒的作用是加快溶解.
故填:加快溶解.
(2)氯化钡和硫酸钠反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
氯化镁和氢氧化钠反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
操作④中加入Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
故填:BaCl2+Na2SO4═BaSO4↓+2NaCl;MgCl2+2NaOH═Mg(OH)2↓+2NaCl;除去氯化钙和过量的氯化钡.
故填:加快溶解.
(2)氯化钡和硫酸钠反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
氯化镁和氢氧化钠反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
操作④中加入Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
故填:BaCl2+Na2SO4═BaSO4↓+2NaCl;MgCl2+2NaOH═Mg(OH)2↓+2NaCl;除去氯化钙和过量的氯化钡.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在).下列说法正确的是( )
右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在).下列说法正确的是( )| A、三种物质溶解度大小依次为:乙>丙>甲 |
| B、若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 |
| C、将温度由t2℃降到t1℃时,析出甲的质量比乙多 |
| D、将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲 |
山梨酸及山梨酸钾是国际粮农组织推荐的高效安全的防腐保鲜剂,它们之间的转化反应为:C6H8O2+KOH═C6H7KO2+X.则X的化学式为( )
| A、H2 |
| B、O2 |
| C、H2O |
| D、H2O2 |


 如图为A、B两种物质的溶解度曲线图.请你据图回答下列问题:
如图为A、B两种物质的溶解度曲线图.请你据图回答下列问题: 水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任.
水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任. 如图标出的是有关巧克力精美包装的组成物质,请回答下列问题.
如图标出的是有关巧克力精美包装的组成物质,请回答下列问题.