题目内容
MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,则M等于
- A.13.2g
- B.6.6g
- C.2.8g
- D.4g
D
分析:利用一定量化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数,由MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,计算出M的值.
解答:根据MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,则:
M×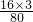 ×100%=6.6g×
×100%=6.6g× ×100%
×100%
M=4g
故选D.
点评:根据化合物的化学式,化合物中某组成元素的质量分数= ×100%.
×100%.
分析:利用一定量化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数,由MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,计算出M的值.
解答:根据MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,则:
M×
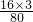 ×100%=6.6g×
×100%=6.6g× ×100%
×100%M=4g
故选D.
点评:根据化合物的化学式,化合物中某组成元素的质量分数=
 ×100%.
×100%. 
练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
MgNH4NO3和6.6g(NH4)2SO4中所含氧元素相等,则M等于( )
| A、13.2g | B、6.6g | C、2.8g | D、4g |