题目内容
(2006?烟台)2005年1月1日起,各地环保部门开始对实验室类污染实施严格的环境监管.某校实验室里有含氢氧化钠和碳酸钠的混合废液10.22 kg,该校用某化工厂废弃的溶质质量分数为14.7%的稀硫酸来处理,并回收处理后的溶液.当向混合废液中加入10 kg稀硫酸时,测得溶液的pH=7,此时溶液总质量为20 kg.(1)原混合废液中碳酸钠的质量是多少?
(2)处理后的溶液的溶质质量分数是多少?
(3)给回收的溶液贴标签时,应如何标明?
【答案】分析:(1)反应过程中溶液的总质量减少,根据碳酸钠与硫酸反应的化学方程式可知:减少的质量是生成二氧化碳的质量,由二氧化碳的质量根据上述反应可以计算出废液中碳酸钠的质量.
(2)由题意知:处理后的溶液中只含硫酸钠.pH=7说明恰好完全反应,因此可以由硫酸的质量计算出硫酸钠的质量,进而计算出处理后的溶液中硫酸钠的质量分数.
(3)标明物质名称和质量分数即可.
解答:解析:设原混合废液中Na2CO3的质量为x.
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 10kg+10.22kg-20kg=0.22kg
 =
= ,x=0.53kg
,x=0.53kg
(2)设处理后的溶液中Na2SO4的质量分数为y.
由Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
2NaOH+H2SO4=Na2SO4+2H2O
得出:H2SO4→Na2SO4
98 142
10kg×14.7% 20kg?y
 =
= ,y=10.65%
,y=10.65%
(3)标签内容:10.65%的Na2SO4溶液.
答:(1)原混合废液中Na2CO3的质量是0.53kg.(2)处理后溶液的溶质质量分数是10.65%.(3)10.65%的Na2SO4溶液.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
注意:处理后的溶液中的溶质硫酸钠由两部分组成,一部分由硫酸和碳酸钠反应生成,另一部分由硫酸和氢氧化钠反应生成.
(2)由题意知:处理后的溶液中只含硫酸钠.pH=7说明恰好完全反应,因此可以由硫酸的质量计算出硫酸钠的质量,进而计算出处理后的溶液中硫酸钠的质量分数.
(3)标明物质名称和质量分数即可.
解答:解析:设原混合废液中Na2CO3的质量为x.
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 10kg+10.22kg-20kg=0.22kg
 =
= ,x=0.53kg
,x=0.53kg(2)设处理后的溶液中Na2SO4的质量分数为y.
由Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
2NaOH+H2SO4=Na2SO4+2H2O
得出:H2SO4→Na2SO4
98 142
10kg×14.7% 20kg?y
 =
= ,y=10.65%
,y=10.65%(3)标签内容:10.65%的Na2SO4溶液.
答:(1)原混合废液中Na2CO3的质量是0.53kg.(2)处理后溶液的溶质质量分数是10.65%.(3)10.65%的Na2SO4溶液.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
注意:处理后的溶液中的溶质硫酸钠由两部分组成,一部分由硫酸和碳酸钠反应生成,另一部分由硫酸和氢氧化钠反应生成.

练习册系列答案
相关题目
(2006?烟台)化学来自生活,用于生活.下表列出了生活中常用物质溶液的pH及一种主要成分(其他成分未列出).
试回答:(1)将上表①~⑤中的主要成分进行分类(填序号,下同)
属于酸的是;属于碱的是;
属于盐的是;属于有机物的是.
(2)当有人被蚊虫(体内含一种酸性物质)叮咬后,为减轻疼痛,可在伤处涂.
(3)铝壶长时间煮水,内有一层水垢[主要含CaCO3和Mg(OH)2],可选用采取少量多次的方法除去,不能采取大量一次的原因是.
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 名称 | 食醋 | 白酒 | 白糖水 | 石灰水 | 纯碱溶液 |
| 溶质成分 | 乙酸 | 乙醇 | 蔗糖 | 氢氧化钙 | 碳酸钠 |
| 溶液pH | 3 | 7 | 7 | 12 | 10 |
属于酸的是;属于碱的是;
属于盐的是;属于有机物的是.
(2)当有人被蚊虫(体内含一种酸性物质)叮咬后,为减轻疼痛,可在伤处涂.
(3)铝壶长时间煮水,内有一层水垢[主要含CaCO3和Mg(OH)2],可选用采取少量多次的方法除去,不能采取大量一次的原因是.
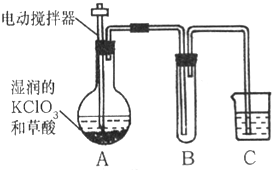 (2006?烟台)用氯气消毒饮用水时,会生成少量对人体有害的有机物.因此,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解.ClO2易与碱反应,其杀菌、漂白能力均优于氯气,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的气味.
(2006?烟台)用氯气消毒饮用水时,会生成少量对人体有害的有机物.因此,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解.ClO2易与碱反应,其杀菌、漂白能力均优于氯气,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的气味. (2006?烟台)请利用水、红磷、量筒和右图所示装置(100mL的注射器、约250mL的广口瓶)测定空气中氧气的体积分数.
(2006?烟台)请利用水、红磷、量筒和右图所示装置(100mL的注射器、约250mL的广口瓶)测定空气中氧气的体积分数.