题目内容
3.物质X可发生如下两个反应:①X+碱→盐+水 ②X+金属氧化物→盐+水.则X可能是下列物质中的( )| A. | CaO | B. | CO2 | C. | NaOH | D. | HNO3 |
分析 由题意,物质x可发生下列所示的两个反应,①X+碱→盐+水、②X+金属氧化物→盐+水,解答本题可采用代入验证法,结合酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应)、碱的化学性质(能与非金属氧化物、酸、一些盐等反应),进行分析判断.
解答 解:A、氧化钙不能与碱反应,不能与金属氧化物反应,故选项错误;
B、二氧化碳能与碱反应生成盐和水,二氧化碳不能与金属氧化物反应,故选项错误;
C、NaOH不能与碱反应,故选项错误;
D、硝酸能与碱发生中和反应生成盐和水,硝酸能与金属氧化物反应生成盐和水,则X可能是硝酸,故选项正确;
故选D.
点评 本题难度不大,掌握酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应)、碱的化学性质(能与非金属氧化物、酸、一些盐等反应)是正确解答本题的关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
14.国际上以碳12原子质量的$\frac{1}{12}$作为相对原子质量的标准,碳12原子的核内有6个质子和6个中子,碳14原子在考古学中常被用来测定出土文物的年代,该原子的核内有6个质子和8个中子,下列关于碳12原子和碳14原子的说法中,不正确的是( )
| A. | 碳14原子的质量比碳12原子的质量大 | |
| B. | 碳14的原子核内质子数为6 | |
| C. | 碳14原子核内有中子数6 | |
| D. | 碳12原子和碳14原子的核外电子数为6 |
18.实验室有失去标签的三瓶无色溶液,分别是氯化镁、氯化钠和氢氧化钠溶液.请你设计出鉴别上述三种溶液的实验方案,叙述实验操作、预期现象和结论.(提示:氯化镁溶液呈弱酸性)
| 实验操作 | 预期现象与结论 |
| 分别取少量无色溶液于三支试管中,再各滴加几滴酚酞溶液,振荡,观察现象. | 若溶液变红色,则原未知溶液为氢氧化钠溶液;若溶液不变色,则原未知溶液是氯化镁溶液或氯化钠溶液. |
| 分别取少量尚未鉴别出的无色溶液于两支试管中,再各滴入少量氢氧化钠溶液,观察现象. | 若产生白色沉淀,则原未知溶液是氯化镁溶液;若无明显现象,则原未知溶液是氯化钠溶液. |
13.CO和CO2混合气体含碳元素36%,取此混合气体10g,通过足量灼热的CuO后,将气体通过足量的澄清石灰水,得到白色沉淀的质量是( )
| A. | 5g | B. | 10g | C. | 20g | D. | 30g |
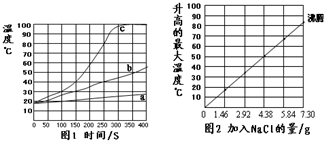 无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
