题目内容
14.下列有关实验现象的描述不正确的是( )| A. | 镁带燃烧,发出耀眼白光,放出大量热,生成白色固体 | |
| B. | 铁钉与稀盐酸反应,银白色固体逐渐减少至消失,溶液由无色变成浅绿色 | |
| C. | 氢氧化钠溶液与氯化铁溶液混合,产生红褐色沉淀 | |
| D. | 甲烷燃烧产生明亮的蓝色火焰,放热 |
分析 A、根据镁带燃烧的现象进行分析判断.
B、根据金属的化学性质,进行分析判断.
C、根据碱的化学性质,进行分析判断.
D、根据甲烷燃烧的现象,进行分析判断.
解答 解:A、镁带燃烧,发出耀眼白光,放出大量热,生成一种白色固体,故选项说法正确.
B、铁钉是用钢制成的,主要成分是铁,含有碳等杂质,铁与稀盐酸反应,生成氯化亚铁和氢气,银白色固体逐渐减少,但不会全部消失,会得到黑色残渣,溶液由无色变成浅绿色,故选项说法错误.
C、氢氧化钠溶液与氯化铁溶液混合,产生红褐色沉淀,故选项说法正确.
D、甲烷燃烧,产生明亮的蓝色火焰,放出大量的热,故选项说法正确.
故选:B.
点评 本题难度不大,掌握碱的化学性质、金属的化学性质、常见物质燃烧的现象即可正确解答,在描述实验现象时,需要注意生成物的颜色、状态.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
4.人类对原子结构的认识经历了一个相当长的时期.以下是科学家及提出的原子结构模型(如图所示),其中符合原子结构模型建立先后顺序的是( )
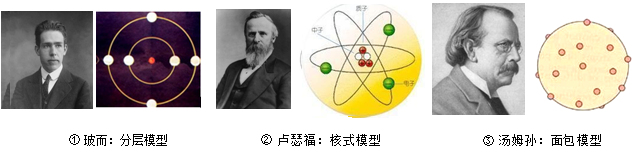

| A. | ①→②→③ | B. | ③→②→① | C. | ①→③→② | D. | ③→①→② |
2.有20gFe2O3和CuO的混合物,进行如下实验:把混合物全部加入到l00g的硫酸溶液中,完全溶解.然后滴加150gl6%的NaOH溶液,恰好完全沉淀.则所用硫酸溶液溶质的质量分数为( )
| A. | 无法计算 | B. | 29.4% | C. | 24% | D. | 36.8% |
19.维生素A的化学名为视黄醇,是最早被发现的维生素.其化学式为C20H30O,下列有关说法正确的是( )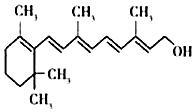

| A. | 维生素A属于有机高分子化合物 | B. | 维生素A中含有碳、氢、氧三种原子 | ||
| C. | 维生素A中氢元素的质量分数最大 | D. | 维生素A分子中含有51个原子 |
3.下表是生活饮用水国家标准的部分内容.
生活饮用水水质常规检验项目及限值(部分)
(1)上表中“铝”指的是元素(选填“单质”、“元素”或“原子”);
(2)生活中硬水软化的方法是煮沸;
(3)实验室用上述水样通电分解,产生氢气和氧气的体积比约为2:1;
(4)消毒剂漂白粉的有效成分是Ca(ClO)2,其中氯元素的化合价是+1价;
(5)1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过180mg/L.
生活饮用水水质常规检验项目及限值(部分)
| 项目 | 限值 |
| 色度 | 不超过15度,并不得呈现其他异色 |
| 浑浊度 | 不超过1度,特殊情况下不超过5度 |
| pH | 6.5-8.5 |
| 总硬度(以CaCO3计) | 450mg/L |
| 铝 | 0.2mg/L |
| 铁 | 0.3mg/L |
| 硫酸盐 | 250mg/L |
(2)生活中硬水软化的方法是煮沸;
(3)实验室用上述水样通电分解,产生氢气和氧气的体积比约为2:1;
(4)消毒剂漂白粉的有效成分是Ca(ClO)2,其中氯元素的化合价是+1价;
(5)1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过180mg/L.


 ’和“
’和“ ”代表两种不同的原子,下图是某化学反应的微观模拟图,请回答问题:
”代表两种不同的原子,下图是某化学反应的微观模拟图,请回答问题: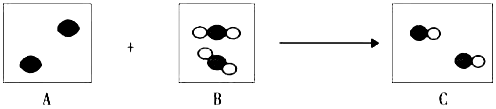
 (画粒子图).
(画粒子图).