题目内容
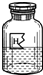 (2006?哈尔滨)某同学在化学实验室发现了一包由两种盐(不含氢元素)组成的白色粉末,和一瓶标签破损的无色溶液(如图),为了确定各自的成分,设计了以下实验:取白色粉末21.8g加入到盛有129.4g该无色溶液的烧杯中,恰好完全反应后,烧杯中只得到含一种溶质的无色溶液149g,溶质中只含两种元素且是农业上一种常用的钾肥.请回答:
(2006?哈尔滨)某同学在化学实验室发现了一包由两种盐(不含氢元素)组成的白色粉末,和一瓶标签破损的无色溶液(如图),为了确定各自的成分,设计了以下实验:取白色粉末21.8g加入到盛有129.4g该无色溶液的烧杯中,恰好完全反应后,烧杯中只得到含一种溶质的无色溶液149g,溶质中只含两种元素且是农业上一种常用的钾肥.请回答:(1)该白色粉末中含有的两种盐是
KCl和K2CO3
KCl和K2CO3
;(2)写出题中发生反应的化学方程式
K2CO3+2HCl═2KCl+CO2↑+H2O
K2CO3+2HCl═2KCl+CO2↑+H2O
;(3)根据已知条件列出求解白色粉末中参加反应物质质量(x)的比例式为
| 138 |
| 44 |
| x |
| 2.2g |
| 138 |
| 44 |
| x |
| 2.2g |
(4)反应后所得无色溶液中溶质分量分数为
15%
15%
.分析:(1)由题意知,白色粉末21.8g加入到盛有129.4g该无色溶液的烧杯中,恰好完全反应后,烧杯中只得到含一种溶质的无色溶液149g,溶液质量减少,说明有气体生成,说明无色溶液是酸,原混合物中含有碳酸盐,由图知,该溶液中溶质的化学式一个氢原子,说明该酸是稀盐酸,又知溶质中只含两种元素且是农业上一种常用的钾肥,说明这种化肥是氯化钾,推出原混合物两种盐是氯化钾和碳酸钾;
(2)根据反应物和生成物以及质量守恒定律写出方程式;
(3)(4)根据生成二氧化碳的质量为:21.8g+129.4g-149g=2.2g作为已知量,设出未知量碳酸钾和生成的氯化钾,根据K2CO3+2HCl═2KCl+CO2↑+H2O 即可求出;
(2)根据反应物和生成物以及质量守恒定律写出方程式;
(3)(4)根据生成二氧化碳的质量为:21.8g+129.4g-149g=2.2g作为已知量,设出未知量碳酸钾和生成的氯化钾,根据K2CO3+2HCl═2KCl+CO2↑+H2O 即可求出;
解答:解:(1)由题意知,白色粉末21.8g加入到盛有129.4g该无色溶液的烧杯中,恰好完全反应后,烧杯中只得到含一种溶质的无色溶液149g,溶液质量减少,说明有气体生成,说明无色溶液是酸,原混合物中含有碳酸盐,由图知,该溶液中溶质的化学式一个氢原子,说明该酸是稀盐酸,又知溶质中只含两种元素且是农业上一种常用的钾肥,说明这种化肥是氯化钾,推出原混合物两种盐是氯化钾和碳酸钾,故填:KCl和K2CO3
(2)碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳,反应的化学方程式为:K2CO3+2HCl═2KCl+CO2↑+H2O
(3)(4)由题意知,生成二氧化碳的质量为:21.8g+129.4g-149g=2.2g,设碳酸钾的质量为x,生成氯化钾的质量为y,
K2CO3+2HCl═2KCl+CO2↑+H2O
138 149 44
x y 2.2g
=
=
x=6.9g
y=7.45g
所以原混合物中氯化钾的质量为:21.8g-6.9g=14.9g
反应后所得无色溶液中溶质分量分数为:
×100%=15%
(2)碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳,反应的化学方程式为:K2CO3+2HCl═2KCl+CO2↑+H2O
(3)(4)由题意知,生成二氧化碳的质量为:21.8g+129.4g-149g=2.2g,设碳酸钾的质量为x,生成氯化钾的质量为y,
K2CO3+2HCl═2KCl+CO2↑+H2O
138 149 44
x y 2.2g
| 138 |
| 44 |
| x |
| 2.2g |
| 149 |
| 44 |
| y |
| 2.2g |
x=6.9g
y=7.45g
所以原混合物中氯化钾的质量为:21.8g-6.9g=14.9g
反应后所得无色溶液中溶质分量分数为:
| 14.9g+7.45g |
| 149 |
点评:本题是一道综合性试题,既考查了学生对知识的整合能力同时又考查了学生进行实验探究的能力.

练习册系列答案
相关题目
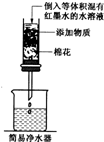 (2006?哈尔滨)某校同学,在学完“碳的几种单质”一节后,自制了三个简易净水器(如图所示),并分别向其中添加了如下表所示的物质,做了三个对比实验.首先取一个大烧杯,装满水,并向其中滴加几滴红墨水,搅拌均匀后,将其分成等体积的三份,再分别倒入三个净水器中,同学们把观察到的溶液的颜色变化情况,记录如下.
(2006?哈尔滨)某校同学,在学完“碳的几种单质”一节后,自制了三个简易净水器(如图所示),并分别向其中添加了如下表所示的物质,做了三个对比实验.首先取一个大烧杯,装满水,并向其中滴加几滴红墨水,搅拌均匀后,将其分成等体积的三份,再分别倒入三个净水器中,同学们把观察到的溶液的颜色变化情况,记录如下.