题目内容
5.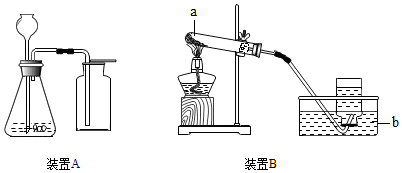 如图是实验室制取气体常用的两套装置.
如图是实验室制取气体常用的两套装置.(1)写出标有字母的仪器名称a试管;b水槽.
(2)选择装置A制取氧气,长颈漏斗中加入的液体试剂是过氧化氢,采用向上排空气法收集氧气的原因是氧气的密度比空气大.
(3)选择装置B用高锰酸钾制取氧气,该装置的不足之处是试管口没有放棉花;反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)实验室用过氧化氢溶液和二氧化锰制氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;二氧化锰起催化作用;要收集0.8g氧气,则参加反应的过氧化氢的质量至少为1.7g.
分析 (1)熟记仪器的名称;
(2)根据装置特点来确定制取方法以及氧气的性质来分析收集方法;
(3)为了防止高锰酸钾粉末进入导管,所以试管口要放一团棉花.写化学方程式时要注意等号上要有反应发生的条件,氧气后要有气体符号;
(4)根据化学方程式的写法以及二氧化锰的催化作用并结合化学方程式来分析解答.
解答 解:(1)a是试管,b是水槽;故答案为:试管;水槽;
(2)用A装置制取氧气,不需加热且有液体参加反应,符合分解过氧化氢制取氧气,所以锥形瓶中放入二氧化锰,长颈漏斗中加入的物质是过氧化氢;因为氧气的密度比空气大,故答案为:过氧化氢;氧气的密度比空气大;
(3)用B装置作为高锰酸钾制取氧气的发生装置时,试管口要放一团棉花,防止高锰酸钾粉末进入导管,所以该装置的不足之处是:试管口没有放棉花.该反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;故答案为:试管口没有放棉花;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)反应物是过氧化氢液体和固体二氧化锰做催化剂制取氧气的化学反应式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
设生成0.8g氧气需要过氧化氢的质量为x,则
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 0.8g
$\frac{68}{32}=\frac{x}{0.8g}$
x=1.7g
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;催化;1.7g.
点评 本题是针对氧气制取的探究,重点对装置的选用探讨,发生装置选用关系到反应物的状态以及反应条件,气体收集装置的选用关系到气体的性质.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 溶液由浅绿色变为蓝色 | B. | 溶液由蓝色变为浅绿色 | ||
| C. | 溶液由蓝色变为红褐色 | D. | 溶液由蓝色变为无色 |
 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小欣和小芳同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小欣和小芳同学很感兴趣,决定对其成分进行探究:(1)这瓶试剂可能是什么溶液呢?
(2)根据受损标签的情况判断,这瓶试剂不可能是A(填字母代号).
A.酸 B.碱 C.盐
(3)Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
(4)①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液.
【设计并实验】
a.小芳用胶头滴管吸取该溶液滴在pH试纸上,测得PH>7,这瓶试剂不可能是NaCl.
b.小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 氢氧化钙溶液 | 产生白色的沉淀 | 猜想②正确 相关的化学方程式Na2CO3+Ca(OH)2═2NaOH+CaCO3↓ |
| A. | 铜丝表面变黑,质量增加 | |
| B. | 变黑的铜丝插入稀硫酸,表面恢复红色 | |
| C. | 变黑的铜丝插入稀硫酸,铜丝质量不变 | |
| D. | 变黑的铜丝插入稀硫酸,溶液质量增加 |
| A. | 一定不含有的只有硫酸铜和碳酸钙 | |
| B. | 一定含有是氯化铵、碳酸铵、硫酸钠 | |
| C. | 不能确定是否含有的是氯化钠和硫酸钠 | |
| D. | 一定含有氯化铵,一定不含有碳酸铵 |
【提出问题】
这包干燥剂是否变质,成分是什么?
【猜想假设】
猜想一:全部是CaO;
猜想二:是CaO和Ca(OH)2的混合物;
猜想三:是氢氧化钙和碳酸钙;
【实验探究】
请你参与实验,并填写表中的空白:
| 实验操作 | 实验现象 | 实验结论 | |
| 第一步 | 取部分该干燥剂于试管中,加水溶液 | 有放热现象 | 说明样品中含有氧化钙 |
| 第二步 | 向第一步的试管中滴加足量稀盐酸 | 有气泡出现 | 说明样品中含有碳酸钙 |
| 第三步 | 另取样品少许,加水溶解,然后滴加无色酚酞溶液 | 溶液变成红色 | 说明样品中含有氢氧化钙 |
同学们认为第三步不能证明原样品中是否有氢氧化钙,理由是氧化钙和水反应也会生成氢氧化钙.同学们在老师的指导下,又补充做了第四步实验,取样品少许,加入硫酸铵固体,混合均匀后放在研钵中研磨,有刺激性气味产生,则说明原样品中一定存在氢氧化钙,该反应的化学方程式为Ca(OH)2+(NH4)2SO4=CaSO4+2H2O+2NH3↑.
【拓展迁移】
小组同学反思了生石灰干燥剂变质的原因,认识到实验室保存氧化钙应密封保存,同学们讨论后认为用铁粉作干燥剂比生石灰更好,原因是铁遇水蒸气和氧气会发生生锈.

| A. | X的化学式为CO2,属于氧化物 | |
| B. | 参加反应的A与B的分子个数比为1:1 | |
| C. | 生成物质X与C的质量比为22:9 | |
| D. | 该反应的化学方程式可以表示C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O |
 某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图:
某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图: