题目内容
9.下列现象描述正确的是CA.硫在空气中燃烧发出微弱的蓝紫色火焰
B.蜡烛在空气中燃烧产生大量白烟
C.木炭在氧气中燃烧发出白光
D.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体.
分析 A、根据硫磺在空气中燃烧的现象进行分析判断.
B、根据蜡烛在空气中燃烧的现象进行分析判断.
C、根据木炭在氧气中燃烧的现象进行分析判断.
D、根据铁丝在氧气中燃烧的现象进行分析判断.
解答 解:A、硫磺在空气中燃烧,发出淡蓝色火焰,放出热量,生成刺激性气味的气体,故选项说法错误.
B、蜡烛在空气中燃烧产生黑烟,故选项说法错误.
C、木炭在氧气中燃烧,发出白光,放出热量,故选项说法正确.
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体.
故选C;补充:铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答;在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
1.下列过程或现象属于物理变化的是( )
| A. | 酒精燃烧 | B. | 食物腐烂 | C. | 冰川融化 | D. | 牛奶变酸 |
18.将4.0gCu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应.过滤、称量滤液的质量.相关实验数据如下:
(1)Cu-Zn合金属于金属材料(“金属”或“有机合成”)
(2)该合金中除Cu、Zn以外的其他成分不与稀硫酸反应,请计算原Cu-Zn合金中Zn的质量分数.写出必要的计算过程.
| 反应前物质的质量/g | 反应后物质的质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液 |
| 4.0 | 10 | 11.26 |
(2)该合金中除Cu、Zn以外的其他成分不与稀硫酸反应,请计算原Cu-Zn合金中Zn的质量分数.写出必要的计算过程.
16.某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题.
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见下表(20℃):
根据上述物质的溶解性,小组同学确定水垢的主要成分中一定含有的两种物质是,可能含有Ca(OH)2和MgCO3.
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
【实验方案2】确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究.其主要实验步骤如下:
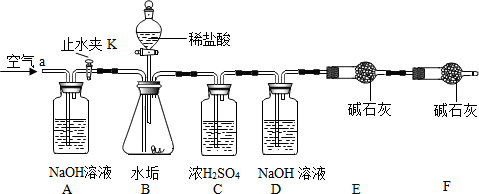
按如图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物).
【实验讨论】
(1)加入药品前应;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是.
(2)C装置的作用是:干燥生成的气体.
(3)装置 B中生成CO2的质量为4.4g.通过计算说明该水垢中(填序号)含MgCO3.
A.一定B.一定不C.可能D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110g.结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数).
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数偏小(填写“偏大”或“偏小”或“不变”).
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见下表(20℃):
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 无白色沉淀 | 水垢中无Ca(OH)2 |
利用下列实验装置,完成实验2探究.其主要实验步骤如下:

按如图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物).
【实验讨论】
(1)加入药品前应;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是.
(2)C装置的作用是:干燥生成的气体.
(3)装置 B中生成CO2的质量为4.4g.通过计算说明该水垢中(填序号)含MgCO3.
A.一定B.一定不C.可能D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110g.结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数).
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数偏小(填写“偏大”或“偏小”或“不变”).
 取甲、乙两支洁净的试管,分别注入3mL淀粉溶液,然后在甲试管中注入2mL新鲜的小麦淀粉酶滤液,在乙试管中注入2mL清水.振荡两支试管,将其下半部浸在37℃左右的温水中约5min,然后同时取出两试管,分别滴入1滴碘液.如图所示,请回答:
取甲、乙两支洁净的试管,分别注入3mL淀粉溶液,然后在甲试管中注入2mL新鲜的小麦淀粉酶滤液,在乙试管中注入2mL清水.振荡两支试管,将其下半部浸在37℃左右的温水中约5min,然后同时取出两试管,分别滴入1滴碘液.如图所示,请回答: