题目内容
2.有关水的认识正确的是( )| A. | 电解水得到H2和O2,可知水是由氢原子和氧原子组成的 | |
| B. | 生活中用过滤的方法可以降低水的硬度 | |
| C. | 净水的方法有沉淀、过滤、吸附、蒸馏 | |
| D. | 经过自来水厂处理的水是纯水 |
分析 A、根据电解水试验的现象和结论分析;
B、根据过滤的原理分析;
C、根据常见的净水的方法分析;
D、根据经过自来水厂处理的水的组成分析.
解答 解:A、电解水得到H2和O2,可知水是由氢元素和氧元素组成的,故A错误;
B、过滤只能除去水中不溶性的杂质,不能降低水的硬度,生活中常用煮沸的方法可以降低水的硬度,故B错误;
C、净水的方法有沉淀、过滤、吸附、蒸馏,故C正确;
D、经过自来水厂处理的水常含有可溶性的杂质,不是纯水,故D错误.
故选C.
点评 本题主要考查了有关水的组成、净化等方面的知识,属于基础的知识,根据已有的知识分析解答即可.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
12.下列关于实验现象的描述,正确的是( )
| A. | 木炭燃烧后生成黑色固体 | |
| B. | 细铁丝伸入盛有氧气的集气瓶中剧烈燃烧 | |
| C. | 红磷燃烧后生成白烟雾 | |
| D. | 硫燃烧后生成有刺激性气味的气体 |
13.长期吸食或注射毒品会危害人体健康甚至危及生命,下列物质都属于毒品的是( )
| A. | 海洛因、黄连素 | B. | 冰毒、大麻 | C. | 甲醛、鸦片 | D. | 摇头丸、黄曲霉素 |
10.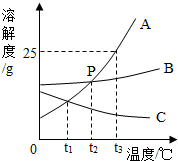 如图是A、B、C三种物质的溶解度曲线,
如图是A、B、C三种物质的溶解度曲线,
①A物质在t3℃时溶解度为25g.
②P点表示t2℃时,A、B物质的溶解度相等.
③t3℃时,把15gA物质放入50克水中充分溶解,所得溶液的质量为62.5克.
 如图是A、B、C三种物质的溶解度曲线,
如图是A、B、C三种物质的溶解度曲线,①A物质在t3℃时溶解度为25g.
②P点表示t2℃时,A、B物质的溶解度相等.
③t3℃时,把15gA物质放入50克水中充分溶解,所得溶液的质量为62.5克.
7.下列家庭小实验不能成功的是( )
| A. | 用食醋和纯碱制取二氧化碳 | |
| B. | 用食盐水除去水瓶中的水垢 | |
| C. | 用肥皂水鉴别家庭用水是否是硬水 | |
| D. | 用花瓣制作指示剂,检验纯碱溶液的酸碱性 |
12.二氧化碳与二氧化硫同为非金属氧化物,某兴趣小组用类比法进行如下探究:
探究一 SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是A、B(填序号,可多选).
A.反应物的状态 B.反应条件 C.气体密度 D.气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验.

通过上述实验,可推测SO2气体的性质有:
①SO2密度比空气大.
②SO2能溶于水等合理答案.
探究二 CO2和SO2性质的比较
兴趣小组设计并进行如图2实验,探究比较CO2和SO2的化学性质.

(3)由实验可知:
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去是SO2,无明显变化的是CO2③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色.
②二氧化硫与碘水反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI
(SO2、I2的相对分子质量分别为:64、254).
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
(4)测定步骤:
Ⅰ.检查装置的气密性.
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)
由实验可知:
①当溶液由蓝色变成无色时反应恰好完全.
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填上表中所列举的等级).
探究一 SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是A、B(填序号,可多选).
A.反应物的状态 B.反应条件 C.气体密度 D.气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验.

通过上述实验,可推测SO2气体的性质有:
①SO2密度比空气大.
②SO2能溶于水等合理答案.
探究二 CO2和SO2性质的比较
兴趣小组设计并进行如图2实验,探究比较CO2和SO2的化学性质.

| 实验Ⅰ | 实验Ⅱ | |
| 通入CO2 | 通入SO2 | |
| 品红溶液 | 无明显变化 | 红色褪为无色 |
| 澄清石灰水 | 白色浑浊 | 白色浑浊 |
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去是SO2,无明显变化的是CO2③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色.
②二氧化硫与碘水反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI
(SO2、I2的相对分子质量分别为:64、254).
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
| SO2最高浓度限值(单位mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
Ⅰ.检查装置的气密性.
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)
由实验可知:
①当溶液由蓝色变成无色时反应恰好完全.
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填上表中所列举的等级).
 A、B、C、D都是初中化学中常见的物质,具有如图所示的转化关系(反应条件、反应物及生成均已略去).
A、B、C、D都是初中化学中常见的物质,具有如图所示的转化关系(反应条件、反应物及生成均已略去). 如图为A、B、C三种固体物质的溶解度曲线,请回答
如图为A、B、C三种固体物质的溶解度曲线,请回答