题目内容
12.小明同学对所学部分化学知识归纳如下:其中完全正确的一组是( )| A.物质的分类 | B.资源的利用和保护 |
| ①合成橡胶、合金都属于合成材料 ②氧化物中含有氧元素 ③混合物中一定含有多种元素 | ①保护空气要减少有害气体和烟尘的排放 ②爱护水资源要节约用水和防止水体污染 ③保护金属资源只能通过防止金属腐蚀实现 |
| C.“低碳经济”的措施 | D.用“化学”眼光分析 |
| ①改造或淘汰高能耗、高污染产业 ②研制和开发新能源替代传统能源 ③减少使用一次性塑料方便袋 | ①洗涤剂去油污是因为洗涤剂具有乳化功能 ②湿衣服晾干是因为分子之间有间隔 ③明矾净水是因为明矾溶于水生成胶状物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据物质的分类与物质的组成来分析;
B.根据资源的利用和环境的保护来分析;
C.根据低碳经济的要求来分析;
D.根据粒子的性质、乳化现象以及净水的原理来分析.
解答 解:A.合成橡胶、合成纤维与塑料属于合成材料;合金属于金属材料;混合物中不一定含有多种元素,如氧气与臭氧组成的混合物中只含一种元素,故A不合题意;
B.保护金属资源可以通过防止金属腐蚀实现,回收废旧金属等途径实验,故B不合题意;
C.改造或淘汰高能耗、高污染产业、研制和开发新能源替代传统能源、减少使用一次性塑料方便袋都有利于能源的节约和减少污染物的排放,符合“低碳经济”的要求,故C符合题意;
D.水分子在不断地运动,所以湿衣服能晾干,故D不合题意.
故选C.
点评 此题涉及合成材料、混合物和氧化物概念知识、资源的保护、分子的性质以及净水的方法、低碳经济的知识点,涉及知识面广,题型综合性强,可谓锻炼学生的好题型.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
2.维生素B2中含C的质量分数为54.3%,H为5.3%,O为25.5%,N为14.9%.其相对分子质量是376,则维生素B2的化学式为( )
| A. | C16H17O7N4 | B. | C17H22O5N4 | C. | C17H20O6N4 | D. | C18H23O6N3 |
3.下列关于“一定”的说法中,正确的是( )
| A. | 氧化物一定是含氧化合物 | |
| B. | 加入稀盐酸,有无色气体产生的物质中一定含有碳酸盐 | |
| C. | 如果某物质不溶解,就一定不能和其他物质发生复分解反应 | |
| D. | 用燃着的木条伸入某气体中,火焰熄灭,则该气体一定是二氧化碳 |
20.下列实验基本操作正确的是( )
| A. |  稀释浓硫酸 | B. |  蒸发食盐水 | C. |  测定溶液PH值 | D. |  加热试管内液体 |
4.规范的操作是实验成功的前提.下列实验操作不正确的是( )
| A. | 将实验过程中剩余的试剂丢弃是浪费行为.所以,实验结束后,都应回收并放回原试剂瓶 | |
| B. | 为了防止液体滴到试管外部,滴管应伸入试管内小心滴加液体 | |
| C. | 用干燥pH试纸来测定溶液的酸碱度 | |
| D. | 没有腐蚀性的药品可直接放在托盘上称量,有腐蚀性的应放在烧杯中称量 | |
| E. | 取用液体药品时,要把瓶塞倒放在桌面上,标签朝向手心,放回原处时标签向外 | |
| F. | 用试管夹夹持试管给液体加热时,不要把拇指按在试管夹短柄上,试管口不能对着自己,试管内液体不超过试管容积的一半 |
3.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
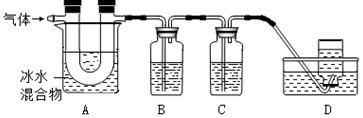
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
 水是人们生活生产中应用最多的物质:
水是人们生活生产中应用最多的物质: