题目内容
10.Fe2O3、CuO的混合粉末共2.4g,高温下与足量的CO充分反应后,将生成的气体通入足量的澄清石灰水,过滤,洗涤,干燥,得固体质量4g,则Fe2O3的质量为( )| A. | 0.8g | B. | 1.2g | C. | 1.6g | D. | 2g |
分析 根据反应方程式判断CO2中的O原子来源于CO和金属氧化物,计算出氧化物中氧元素的质量.
解答 解:设生成的二氧化碳的质量为x.
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 4g
则$\frac{44}{x}=\frac{100}{4g}$,
解得x=1.76g
发生的有关反应为:Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,
从反应方程式可以看出,二氧化碳中的氧元素一半来自金属氧化物,故金属氧化物中氧元素的质量为1.76g×$\frac{16×2}{44}$÷2=0.64g.
设Fe2O3的质量为y,则CuO的质量为(2.4g-y).
其中氧元素的质量为:y×$\frac{16×3}{16×3+56×2}×100%$+(2.4g-y)×$\frac{16}{16+64}×100%$=0.64g.
y=1.6g
故选:C.
点评 本题考查混合物的质量计算,题目难度较大,注意从元素质量守恒的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.甲、乙、丙、丁四种物质,一定条件下在密闭容器中充分反应,测得反应前后个物质的质量分数如表,下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量分数 | 48% | 25% | 10% | 17% |
| 反应后物质质量分数 | 30% | 41% | m | 19% |
| A. | m的值为0 | B. | 该反应的基本类型为分解反应 | ||
| C. | 该反应可能是过氧化氢的分解 | D. | 物质丙一定是该反应的催化剂 |
2.下列说法不正确的是( )
| A. | 活性炭具有吸附性,所以可用于防毒面具 | |
| B. | 金刚石,石墨分子构成不同,所以性质不同 | |
| C. | 将煤块制成蜂窝煤,可以增大反应物的接触面积,使燃烧更充分 | |
| D. | 炼铁的原理是利用一氧化碳与氧化铁反应 |
20.把一定质量的锌和镁分别投入到适量的稀盐酸中,充分反应后,生成等质量的氢气,则投入的锌和镁的质量比是( )
| A. | 1:1 | B. | 65:24 | C. | 24:65 | D. | 无法确定 |
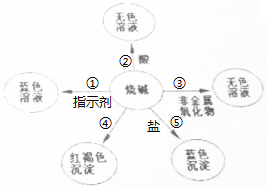 (1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜.
(1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜.