题目内容
三聚氰胺(C3H6N6)是一种重要的化工原料,可由尿素[CO(NH2)2]发生如下反应制取:6CO(NH2)2
C3H6N6+6X↑+3CO2↑.推断并计算:
(1)根据化学方程式推断:X的化学式为 .
(2)制取12.6g三聚氰胺,最少需要尿素的质量.
(3)三聚氰胺中氮元素的质量分数(结果精确到0.1%).
(4)蛋白质中氮元素的质量分数平均为16%,16g三聚氰胺与多少克蛋白质的含氮量相当?
| 一定条件 |
(1)根据化学方程式推断:X的化学式为
(2)制取12.6g三聚氰胺,最少需要尿素的质量.
(3)三聚氰胺中氮元素的质量分数(结果精确到0.1%).
(4)蛋白质中氮元素的质量分数平均为16%,16g三聚氰胺与多少克蛋白质的含氮量相当?
考点:质量守恒定律及其应用,元素的质量分数计算,化合物中某元素的质量计算
专题:化学式的计算,化学用语和质量守恒定律
分析:(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,进行解答.
(2)根据化学方程式6CO(NH2)2
C3H6N6+6X↑+3CO2↑,进行计算;
(3)根据化合物中元素的质量分数=
×100%,进行分析解答
(4)根据题意,蛋白质中含氮量平均为16%;若在奶粉中加了1g三聚氰胺,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
(2)根据化学方程式6CO(NH2)2
| 一定条件 |
(3)根据化合物中元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
(4)根据题意,蛋白质中含氮量平均为16%;若在奶粉中加了1g三聚氰胺,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答:解:
(1)在反应中,6CO(NH2)2
C3N6H6+6X↑+3CO2↑,反应前,碳、氧、氮、氢的原子个数分别是6、6、12、24,反应后碳、氧、氮、氢的原子个数分别是3、6、6、6,在化学反应中,反应前后原子的种类没有改变,数目没有增减,可推断出X的化学式为:NH3
(2)根据6CO(NH2)2
C3H6N6+6X↑+3CO2↑,则可知三聚氰胺和尿素的质量比为300:126,则设最少需要尿素的质量为x,则
=
,则解得x=36g.
(3)三聚氰胺中氮元素的质量分数=
×100%≈66.7%
(4)如果在奶粉中加了1g三聚氰胺,其中含氮元素的质量为1g×66.7%=0.667g;相当于增加了蛋白质的质量为0.667g÷16%≈4.2g.则16g三聚氰胺相当于增加了蛋白质的质量为4.2g×16=67.2g
故答案为:
(1)NH3;(2)36g;(3)66.7%;(4)67.2g
(1)在反应中,6CO(NH2)2
| 一定条件 |
(2)根据6CO(NH2)2
| 一定条件 |
| 360 |
| 126 |
| x |
| 12.6g |
(3)三聚氰胺中氮元素的质量分数=
| 14×6 |
| 126 |
(4)如果在奶粉中加了1g三聚氰胺,其中含氮元素的质量为1g×66.7%=0.667g;相当于增加了蛋白质的质量为0.667g÷16%≈4.2g.则16g三聚氰胺相当于增加了蛋白质的质量为4.2g×16=67.2g
故答案为:
(1)NH3;(2)36g;(3)66.7%;(4)67.2g
点评:本题主要考查学生运用化学式进行计算的能力.学生要能正确分析三聚氰胺的分子结构示意图,得出其化学式,在解答过程中,要注意解题的格式.

练习册系列答案
相关题目
在日常生活中,下列做法不正确的是( )
| A、用小苏打治疗胃酸过多症 |
| B、用食醋除去热水瓶胆内壁上的水垢 |
| C、蚊虫叮咬后,为了减轻痛苦,在痛痒的皮肤上涂柠檬汁 |
| D、用纯碱除去餐具上的油污 |
下列属于“空气污染指数”需要监测污染物是( )
| A、氮气 | B、可吸入颗粒物 |
| C、稀有气体 | D、二氧化碳 |
 某实验小组同学完成制取二氧化碳的实验后,对回收的100g盐酸和氯化钙混合溶液(不含其它的杂质)进行如下实验:取一定量该混合溶液放入烧杯中,再滴入200g溶质质量分数为10.6%的碳酸钠溶液.滴入碳酸钠溶液的质量与生成沉淀的质量的关系如图所示.
某实验小组同学完成制取二氧化碳的实验后,对回收的100g盐酸和氯化钙混合溶液(不含其它的杂质)进行如下实验:取一定量该混合溶液放入烧杯中,再滴入200g溶质质量分数为10.6%的碳酸钠溶液.滴入碳酸钠溶液的质量与生成沉淀的质量的关系如图所示.
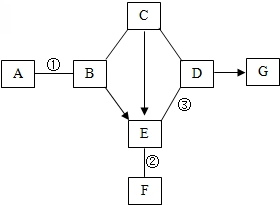 如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.