题目内容
2. 将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体的质量与温度的关系如图所示,下列说法正确的是( )
将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体的质量与温度的关系如图所示,下列说法正确的是( )| A. | 甲的溶解度随温度升高而增大 | |
| B. | t1℃时,甲、乙的溶解度均为20g | |
| C. | a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b | |
| D. | 温度由t2℃降低到t1℃时,甲溶液析出5g固体 |
分析 根据随温度变化剩余固体的质量结合溶解度的概念进行分析解答即可.
解答 解:A、据图可以看出,温度升高,甲剩余的固体质量增多,说明甲的溶解度随温度的升高而减小,错误;
B、t1℃时,剩余固体都是10g,说明溶解了20g,甲、乙的溶解度均为40g,错误;
C、将质量均为30g的甲、乙两种固体分别加入到50g水中,c中剩余固体最少,a中次之,b中剩余固体最多,所以a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b,正确;
D、温度由t2℃降低到t1℃时,固体减少5g,应该是溶解了5g,错误;
故选C.
点评 本题难度不是很大,主要考查了固体的溶解度的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
8. 将CO2和O2通入图中装置进行净化,最终得到的气体是( )
将CO2和O2通入图中装置进行净化,最终得到的气体是( )
 将CO2和O2通入图中装置进行净化,最终得到的气体是( )
将CO2和O2通入图中装置进行净化,最终得到的气体是( )| A. | CO2、O2 | B. | CO2 | C. | O2 | D. | O2、H2O |
10.下列各组物质在给定pH的溶液中能大量共存并形成无色溶液的是( )
| A. | pH为12:BaCl2、Na2CO3、NaOH | B. | pH为1:NaOH、KHCO3、Na2SO4 | ||
| C. | pH为2:KNO3、NaCl、H2SO4 | D. | pH为3:FeCl3、CuSO4、KCl |
17.喜爱阅读的同学发现,化学课本中的图表资料可以为我们提供很多信息.
表一:部分酸、碱和盐的溶解性表(20℃)
表二:部分法定计量单位
①Ⅰ处物质的名称是硫酸亚铁,该物质溶(填“溶”或“不溶”)于水.
②Ⅱ处“量的名称”是物质的量,Ⅲ处“单位符号”是g/mol.
表一:部分酸、碱和盐的溶解性表(20℃)
| 氢氧根和酸根 原子和原子团 | $\stackrel{-1}{OH}$ | $\stackrel{-2}{S{O}_{4}}$ |
| … | … | … |
| $\stackrel{+2}{Fe}$ | 不 | Ⅰ |
| … | … | … |
| 量的名称 | 量的符号 | 单位名称 | 单位符号 | 备注 |
| … | … | … | … | … |
| Ⅱ | n | … | mol | … |
| 摩尔质量 | M | … | Ⅲ | … |
②Ⅱ处“量的名称”是物质的量,Ⅲ处“单位符号”是g/mol.
7.某同学梳理归纳了以下知识点:①用水灭火的原理是降低了可燃物的着火点;②饱和溶液一定是该温度下该种溶质形成的最浓的溶液;③“粗盐中难溶性杂质的去除”的实验中,当蒸发皿中出现较多固体时,停止加热;④用点燃的方法能除去二氧化碳中混有的少量一氧化碳;⑤洗涤剂能去除油污是因为洗涤剂可以溶解油污;⑥日常生活中的不锈钢、铝合金和生铁都属于合金.其中正确的组合( )
| A. | ①⑤⑥ | B. | ②④⑤ | C. | ②③⑥ | D. | ③④⑥ |
14.在Cu(NO3)2和AgNO3的混合溶液中加入一定量的Zn,充分反应后过滤,留在滤纸上的固体一定( )
| A. | 有Zn | B. | 有ZnCuAg | C. | 有Cu和Ag | D. | 有Ag |
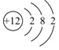 ,镁元素位于周期表中第三周期.;
,镁元素位于周期表中第三周期.; A-F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作农业上改良酸性土壤,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去),请回答:
A-F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作农业上改良酸性土壤,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去),请回答: