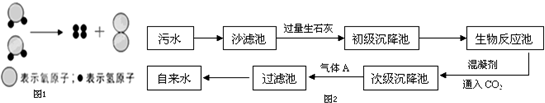
题目内容
 如图为某学习小组在白色点滴板上进行的有关“碱的化学性质”的探究实验
如图为某学习小组在白色点滴板上进行的有关“碱的化学性质”的探究实验(1)使用白色点滴板进行实验的优点是
(2)氢氧化钠溶液和氢氧化钙溶液都能使无色的酚酞试液变红,是因为在不同碱的溶液中都含有相同的
(3)实验室盛放石灰水的瓶中常形成一层不溶与水的固体,形成该固体的化学方程式是
考点:碱的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的碱 碱的通性
分析:(1)根据使用白色点滴板进行实验的具体操作中出现的各种情况来分析其优点;
(2)根据碱的溶液中都存在的离子来分析其都能使无色的酚酞试液变红的原因.
(3)根据氢氧化钙的化学性质,可以知道石灰水可以和二氧化碳反应生成碳酸钙,可以据此结合碳酸钙的性质来解答.
(2)根据碱的溶液中都存在的离子来分析其都能使无色的酚酞试液变红的原因.
(3)根据氢氧化钙的化学性质,可以知道石灰水可以和二氧化碳反应生成碳酸钙,可以据此结合碳酸钙的性质来解答.
解答:解:(1)使用白色点滴板进行实验,药品的用量少,则可节约药品,同时可减少对环境的污染,有时可以同时完成几个实验,便于观察比较
(2)因氢氧化钠溶液和氢氧化钙溶液中都含有相同的氢氧根离子,则它们都能使无色的酚酞试液变红;
(3)石灰水中的氢氧化钙会与空气中的二氧化碳反应生成的白色的碳酸钙,所以该白色薄膜是碳酸钙,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.因为碳酸钙可以与稀盐酸反应,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳.所以除去该薄膜可用稀盐酸,该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)节约药品(可减少对环境的污染;可同时完成多个实验;便于观察实验现象等合理答案均可);
(2)氢氧根(OH-).
(3)CO2+Ca(OH)2═CaCO3↓+H2O;稀盐酸;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)因氢氧化钠溶液和氢氧化钙溶液中都含有相同的氢氧根离子,则它们都能使无色的酚酞试液变红;
(3)石灰水中的氢氧化钙会与空气中的二氧化碳反应生成的白色的碳酸钙,所以该白色薄膜是碳酸钙,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.因为碳酸钙可以与稀盐酸反应,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳.所以除去该薄膜可用稀盐酸,该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)节约药品(可减少对环境的污染;可同时完成多个实验;便于观察实验现象等合理答案均可);
(2)氢氧根(OH-).
(3)CO2+Ca(OH)2═CaCO3↓+H2O;稀盐酸;CaCO3+2HCl═CaCl2+H2O+CO2↑.
点评:本题考查学生对实验的操作和实验现象的原因分析,学生应学会利用实际操作来分析实验特点,学会利用物质的组成来分析性质的相似之处.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
从图所示的两种微粒结构示意图中,获取的信息不正确的是( )
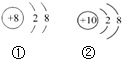
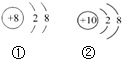
| A、它们属于同种原子形成的微粒 |
| B、它们的核外电子层数相同 |
| C、它们的核外电子数相同 |
| D、①表示阴离子,②表示原子 |
 如图是水电解实验示意图:
如图是水电解实验示意图: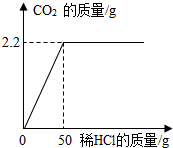 为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求:
为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求: