题目内容
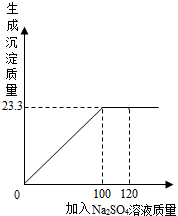
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(水的密度 1g/cm3),向所得溶液中滴加质量分数 为14.2 %的Na2SO4溶液,至恰好完全反应。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
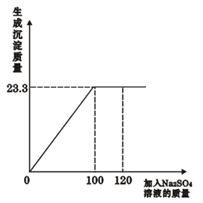
(1)生成沉淀的质量是 。
(2)所得溶液中溶质的质量分数为多少?
(1)23.3g (2) 10%
【解析】
试题分析:根据复分解反应发生的条件分析,混合物中的NaCl和滴加的Na2SO4不能反应;而混合物中的BaCl2和滴加的Na2SO4溶液反应,生成BaSO4沉淀和氯化钠;且根据图示可知,当Na2SO4溶液滴加至100g时,二者恰好完全反应(因为此后沉淀质量不再改变)。
(1)由图可知,生成BaSO4沉淀的质量为23.3g。
(2)根据题意可知,当二者恰好完全反应时,所得溶液为NaCl溶液,且其中溶质NaCl有两部分:一是原混合物中含有的NaCl,二是反应后生成的NaCl。
解:设生成的氯化钠的质量为X,参加反应的氯化钡的质量为Y
Na2SO4+ BaCl2= 2NaCl + BaSO4↓
208 117 233
Y X 23.3g
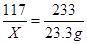
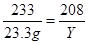
解得, X=11.7g,Y=20.8g
则所得溶液中溶质的质量分数=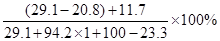 =10%
=10%
答:反应后所得溶液中溶质的质量分数为10%。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的识图能力和数据分析能力,解题的关键是根据图像判断出恰好完全反应的点,从而找到生成沉淀硫酸钡的质量,然后依据已知量对未知的应求量进行求解计算即可;特别要注意的是,反应后的溶质氯化钠包含两部分:即反应生成的氯化钠和原固体混合物中的氯化钠。

 将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(ρ水=1lg/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应,下图是所加Na2SO4溶液质量与生成沉淀质量的关系图.
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(ρ水=1lg/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应,下图是所加Na2SO4溶液质量与生成沉淀质量的关系图. 将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加质
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加质 将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加一定质量分数的Na2SO4溶液.下图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加一定质量分数的Na2SO4溶液.下图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算: 将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加质
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加质