题目内容
某课外学习小组对过氧化氢的分解反应进行探究,实验条件及产生的现象见下表:| 实验序号 | 实验温度/℃ | 催化剂 | 5%H2O2溶液体积/mL | 实验现象 |
| (1) | 20 | 无 | 10 | 无明显现象 |
| (2) | 50 | 无 | 10 | 有气泡产生 |
| (3) | 20 | 1gCuCl2 | 10 | 有气泡产生 |
| (4) | 20 | 1gFeCl3 | 10 | 有气泡产生(快慢与(3)不同) |
 对此反应无催化作用)
对此反应无催化作用)根据以上信息回答下列问题:
(1)写出实验(4)的化学方程式______ 2H2O+O2↑
(2)根据对比实验(1)与(2)的条件可知,是温度不同进行解答;
(3)根据对比实验(3)与(4)的条件可知,是催化剂不同进行解答;
(4)根据资料可知钠离子和硫酸根离子对此反应无催化作用,假设1找一种试剂只含有铁离子而不含有氯离子的物质进行实验即可;假设2找一种试剂只含有氯离子而不含有铁离子的物质进行实验即可;假设3找一种试剂即含有氯离子又含有铁离子的物质进行实验即可;
(5)根据催化剂化学反应前后质量和化学性质不变进行解答;
(6)根据用长颈漏斗和小试管相当于分液漏斗进行解答.
解答:解:(1)过氧化氢在氯化铁作催化剂的条件生成水和氧气,化学方程式:2H2O2
 2H2O+O2↑;
2H2O+O2↑;(2)对比实验(1)与(2)可知二者的温度不同,所以实验(1)与(2)的目的是探究温度不同对过氧化氢的分解放出氧气的影响;
(3)对比实验(3)与(4)可知二者的催化剂不同,实验(3)与(4)的目的是探究催化剂不同对过氧化氢的分解放出氧气的影响;
(4)资料可知钠离子和硫酸根离子对此反应无催化作用.假设1找一种试剂只含有铁离子而不含有氯离子的物质进行实验即可,例如硫酸铁;假设2找一种试剂只含有氯离子而不含有铁离子的物质进行实验即可,例如氯化钠;假设3找一种试剂即含有氯离子又含有铁离子的物质进行实验即可,试剂为氯化铁;
(5)催化剂化学反应前后质量和化学性质不变,为了证明FeCl3是该反应的催化剂,还需:①验证FeCl3在反应前后质量不变;②验证FeCl3在反应前后化学性质不变;
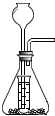
(6)小明又能给H2O2和MnO2按如图装置制取少量的O2,其中长颈漏斗和小试管相当于分液漏斗,所以小试管的作用是:可以控制参加反应的过氧化氢的量,又可以节约过氧化氢.
故答案为:(1)2H2O2
 2H2O+O2↑;
2H2O+O2↑;(2)温度不同对过氧化氢的分解放出氧气的影响;
(3)催化剂不同对过氧化氢的分解放出氧气的影响;
(4)硫酸铁;氯化钠;氯化铁;
(5)FeCl3在反应前后化学性质不变;
(6)可以控制参加反应的过氧化氢的量,又可以节约过氧化氢.
点评:培养观察记录实验现象,分析实验结果和处理实验数据,得出正确结论的能力;学会归纳总结、对比分析.

某课外学习小组对过氧化氢的分解反应进行探究,实验条件及产生的现象见下表:
| 实验序号 | 实验温度/0C | 催化剂 | 5%H2O2溶液体积/mL | 实验现象 |
| (1) | 20 | 无 | 10 | 无明显现象 |
| (2) | 50 | 无 | 10 | 有气泡产生 |
| (3) | 20 | 1gCuCl2 | 10 | 有气泡产生 |
| (4) | 20 | 1gFeCl3 | 10 | 有气泡产生[快慢与(3)不同] |
(资料显示Na+、SO42-对此反应无催化作用)根据以上信息回答下列问题:
(1)写出实验(4)的化学方程式 ;
(2)实验(1)与(2)的目的是探究 ;
(3)实验(3)与(4)的目的是探究 ;
(4)为了进一步探究FeCl3在溶液中起催化作用的是什么离子,还应进一步设计实验,请根据提出的假设填写所需试剂;
| 提出假设 | 除H2O2外至少还需选用的试剂 |
| 假设l:只有Fe3+有催化作用 | ① |
| 假设2:只有Cl-有催化作用 | ② |
| 假设3:Fe3+ 、Cl一都有催化作用 | ③ |

(5)为了证明FeCl3是该反应的催化剂,还需:
①验证FeCl3在反应前后质量不变;
②验证 。
(6)小明用H2O2和MnO2按右图装置制取少量的O2,其中小试管的作用是
。(填2种即可)