题目内容
3.将20g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,反应停止后,烧杯和烧杯内剩余物的总质量为219.4g,求:(可能用到的相对原子质量:Zn:65H:1 )(1)反应后生成氢气的质量;
(2)此20g含杂质的锌粒中金属锌的质量分数.
分析 根据题意,由于锌与硫酸反应放出氢气而使锌完全反应前后物质的总质量有所减小,减小的质量即放出氢气的质量,运用质量守恒定律,求出氢气质量;然后由氢气质量,根据反应的化学方程式,计算出含杂质的锌粒中金属锌的质量即可求得含杂质的锌粒中金属锌的质量分数.
解答 解:(1)根据质量守恒定律,反应中生成氢气的质量=20g+200g-219.4g=0.6g;
(2)设含杂质的锌粒中金属锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.6g
$\frac{65}{x}=\frac{2}{0.6g}$
x=19.5g
这20g含杂质的锌粒中金属锌的质量分数=$\frac{19.5g}{20g}×$100%=97.5%
答案:
(1)反应后生成氢气的质量为0.6g;
(2)此20g含杂质的锌粒中金属锌的质量分数为97.5%.
点评 利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
13.能与稀硫酸、氧气、硫酸铜溶液都能反应的物质是( )
| A. | 碳 | B. | 二氧化碳 | C. | 铁 | D. | 酒精 |
14.下列化学变化中吸收热量的是( )
| A. | 红磷在氧气中的燃烧 | B. | 高温煅烧石灰石 | ||
| C. | 镁条和稀盐酸的反应 | D. | 石灰石与水反应 |
11.下列物质能由金属与酸反生置换反应制得的是( )
| A. | CuSO4 | B. | MgCl2 | C. | FeCl3 | D. | Hg(NO3)2 |
18.常温下将铁片分别放入下列物质中,观察不到明显现象的是( )
| A. | 蒸馏水 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 硫酸铜溶液 |
15.下列金属材料不属于合金的是( )
| A. | 青铜 | B. | 生铁 | C. | 紫铜 | D. | 焊锡 |
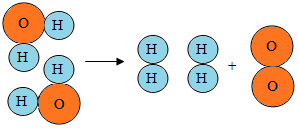 水是重要的自然资源.
水是重要的自然资源.