题目内容
1.请根据如图所示的实验过程和提供的数据计算: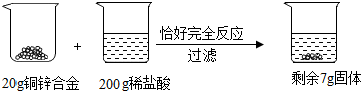
(1)合金中锌的质量是13g,生成氢气0.4g;
(2)所用稀盐酸的溶质质量分数是多少?(计算结果保留小数后一位).
分析 由图中数据分析可知,剩余的7g固体即为铜,稀盐酸消耗锌粒20g-7g=13g结合化学方程式来分析解答即可.
解答 解:由图中数据分析可知,剩余的7g固体即为铜,稀盐酸消耗锌粒20g-7g=13g
设参加反应的HCl的质量为x,生成氢气y
Zn+2HCl═ZnCl2+H2↑,
65 73 2
13g x y
$\frac{65}{13g}$=$\frac{73}{x}$=$\frac{2}{y}$
x=14.6g,y=0.4g
所用稀盐酸的溶质质量分数是$\frac{14.6g}{200g}$×100%=7.3%
答:(1)13;0.4;(2)所用稀盐酸的溶质质量分数是7.3%
点评 因为铜不与酸反应,因此反应后剩余固体的质量就是铜的质量,消耗的即为锌的质量,要注意正确理解题意来分解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.丁二酮(C4H6O2)是一种浅黄绿色液体,有强烈的奶油香味,常作食品的增香剂,下列关于丁二酮的说法中正确的是( )
| A. | 丁二酮是由C、H、O三种元素组成的 | B. | 丁二酮分子中含有氧分子 | ||
| C. | 丁二酮中各元素的质量比为2:3:1 | D. | 丁二酮中氢元素的质量分数为50% |
9.美国化学教材把化学反应分为5种类型,除“化合反应”、“分解反应”、“置换反应”、“复分解反应”外,第五种就是“燃烧反应”--“一种物质快速结合氧气生成一种或多种氧化物的反应”.下列反应既不是“化合反应”又不是“燃烧反应”的是( )
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$ SO2 | B. | CO2+H2O=H2CO3 | ||
| C. | HCl+NaOH=NaCl+H2O | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 |
16.下列物质(括号内数据是该物质的pH)呈碱性的是( )
| A. | 酱油(4-5) | B. | 西瓜汁(5-6) | C. | 液体肥皂(9-11) | D. | 柠檬(2-3) |
6.下列材料属于合成材料的是( )
| A. | 羊毛 | B. | 水泥 | C. | 合金 | D. | 塑料 |
13.在我们生活中,进行的下列活动,其中涉及到化学变化的是( )
| A. | 饮水机通电后将水煮沸 | |
| B. | 农村将熟石灰洒在酸性土壤改善土质 | |
| C. | 用充气泵向鱼池中充气避免鱼缺氧 | |
| D. | 用砂布擦拭铁制零件上的铁锈 |
10.下列去除粗盐中难溶性杂质实验的说法中正确的是( )
| A. | 过滤时用手指沾水将滤纸紧贴于漏斗内壁 | |
| B. | 过滤时滤纸边缘要低于漏斗边缘 | |
| C. | 蒸发滤液时,待蒸发皿中滤液蒸干后再停止加热 | |
| D. | 在粗盐溶解、过滤、蒸发 过程中,玻璃棒所起作用相同 |

