题目内容
16.小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0克的烧杯中,再往烧杯中加入100.0克的稀盐酸(杂质不与酸反应、不溶于水)至不再产生气泡为止,并对烧杯及杯内物质称量为161.0克.求:(1)反应产生的氢气的质量
(2)该铁合金中铁的质量分数(保留一位小数)
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算铁的质量.
解答 解:根据质量守恒定律可得,生成的氢气的质量为11.4g+50.0g+100.0g-161.0g=0.4g
设参加反应的铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
$\frac{56}{2}$=$\frac{x}{0.4g}$
x=11.2g
该铁合金中铁的质量分数为$\frac{11.2g}{11.4g}$×100%≈98.2%
答:(1)反应产生的氢气的质量为0.4g
(2)该铁合金中铁的质量分数为98.2%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
4.下列物质属于氧化物的是( )
| A. | H2O | B. | CH4 | C. | KClO3 | D. | O2 |
1.下列说法错误的是( )
| A. | 在溶液中K+和SO42-能大量共存 | |
| B. | 氯化钠是由氯化钠分子构成的 | |
| C. | 最外层电子数决定了元素的化学性质 | |
| D. | 木炭还原氧化铜反应中,氧化铜是氧化剂,木炭是还原剂 |
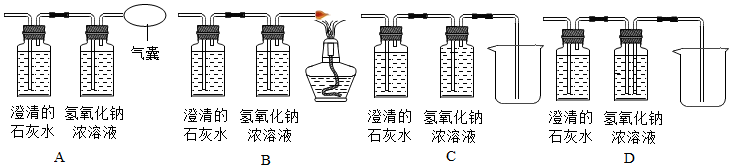
8.图中可用于验证质量守恒定律实验的是( )
| A. |  | B. |  | C. |  | D. |  |
 气体的制取和收集是初中化学的核心知识.小组同学在实验室进行气体制取的探究,请你一同参与:
气体的制取和收集是初中化学的核心知识.小组同学在实验室进行气体制取的探究,请你一同参与: 如图是水分子分解示意图,请你写出获得的化学信息.(写3出点)
如图是水分子分解示意图,请你写出获得的化学信息.(写3出点)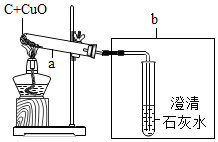 某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.
某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.