题目内容
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示:
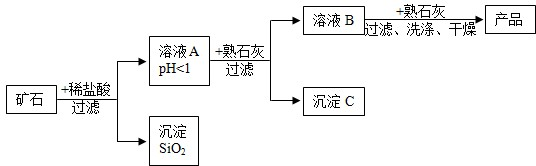
(1)溶液A中共含有 种阳离子;
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为 ;
(3)溶液B中一定含有的溶质为 (填化学式);可能含有的溶质为 .
(4)写出溶液B中加入熟石灰,生成产品的化学方程式: .

(1)溶液A中共含有
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出溶液B中加入熟石灰,生成产品的化学方程式:
考点:物质的相互转化和制备,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:本题考查碱的制备.组成矿石的四种氧化物中仅SiO2不与盐酸反应,其余三种均能反应:
MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反映后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+;要使Mg(OH)2纯度高、损失少,必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内,即6.7<pH<8.6的范围内;溶液B中一定有氯化镁,则B中加入熟石灰的反应为:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓
MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反映后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+;要使Mg(OH)2纯度高、损失少,必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内,即6.7<pH<8.6的范围内;溶液B中一定有氯化镁,则B中加入熟石灰的反应为:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓
解答:解:
(1)溶液A中共含有4种阳离子,它们是Mg2+、Fe3+、Cu2+、H+;故填:4.
(2)为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6,即必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内.故填:6.7~8.6.
(3)当B溶液的pH在6.7~8.6时,铜离子已经完全沉淀,镁离子没有形成沉淀,所以溶液B中一定含有的溶质为氯化镁和反应生成的氯化钙,化学式分别是MgCl2、CaCl2.可能含有的溶质为 HCl、Ca(OH)2.
故填:MgCl2、CaCl2. HCl、Ca(OH)2.
(4)氯化镁和氢氧化钙反应能生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故填:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故答案为:
(1)4;
(2)6.7-8.6;
(3)MgCl2、CaCl2; HCl、Ca(OH)2.
(4)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
(1)溶液A中共含有4种阳离子,它们是Mg2+、Fe3+、Cu2+、H+;故填:4.
(2)为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6,即必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内.故填:6.7~8.6.
(3)当B溶液的pH在6.7~8.6时,铜离子已经完全沉淀,镁离子没有形成沉淀,所以溶液B中一定含有的溶质为氯化镁和反应生成的氯化钙,化学式分别是MgCl2、CaCl2.可能含有的溶质为 HCl、Ca(OH)2.
故填:MgCl2、CaCl2. HCl、Ca(OH)2.
(4)氯化镁和氢氧化钙反应能生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故填:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故答案为:
(1)4;
(2)6.7-8.6;
(3)MgCl2、CaCl2; HCl、Ca(OH)2.
(4)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知A、B、C、D、E是初中化学常见的物质,D物质的水溶液为蓝色,E是相对分子质量最小的氧化物,它们的转化关系如图所示:
已知A、B、C、D、E是初中化学常见的物质,D物质的水溶液为蓝色,E是相对分子质量最小的氧化物,它们的转化关系如图所示: A、B、C、D、E 都是初中化学常见的物质,其中D是一种紫红色金属单质,它们之间的转化关系如右图所示,反应条件均已略去.
A、B、C、D、E 都是初中化学常见的物质,其中D是一种紫红色金属单质,它们之间的转化关系如右图所示,反应条件均已略去.
 如图是A、B、C三种物质的溶解度曲线.请回答:
如图是A、B、C三种物质的溶解度曲线.请回答: