题目内容
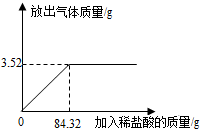
加热6.32gKMnO4,当剩余物的质量为5.68g时停止加热,则剩余物中含有的物质是______.
根据质量守恒定律,停止加热时放出氧气质量=6.32g-5.68g=0.64g
设分解的高锰酸钾的质量为x
2KMnO4
K2MnO4+MnO2+O2↑
316 32
x 0.64g
=
x=6.32g
可判断所取6.32g KMnO4完全分解,则剩余物中含有的物质为K2MnO4、MnO2;
答案:锰酸钾、二氧化锰(K2MnO4、MnO2);
设分解的高锰酸钾的质量为x
2KMnO4
| ||
316 32
x 0.64g
| 316 |
| x |
| 32 |
| 0.64g |
x=6.32g
可判断所取6.32g KMnO4完全分解,则剩余物中含有的物质为K2MnO4、MnO2;
答案:锰酸钾、二氧化锰(K2MnO4、MnO2);

练习册系列答案
相关题目