题目内容
4.下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
| A. | 向一定量过氧化氢溶液中加入少量二氧化锰 | |
| B. | 向相同质量与浓度的稀盐酸分别加入铁粉和锌粉 | |
| C. | 向相同质量的铁粉和锌粉中分别加入足量稀盐酸 | |
| D. | 一氧化碳与一定量氧化铁在高温条件下完全反应 |
分析 A.过氧化氢溶液在二氧化锰的催化作用之下能够分解产生氧气和水来分析;
B.根据酸与金属的反应过程来分析;
C.在金属活动性顺序中,氢前的金属能与酸反应生成氢气;
D.根据一氧化碳还原氧化铁的过程来分析.
解答 解:A.过氧化氢溶液在二氧化锰的催化作用之下能够分解产生氧气,而导致溶液中氧元素的质量减少,但是氢元素的质量不变,溶液的质量减少,则溶液中氢元素的质量分数变大,故不正确;
B.铁与盐酸反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;锌与盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;
56 73 2 65 73 2
由以上化学方程式可知,向相同质量与浓度的稀盐酸分别加入铁粉(足量)和锌粉(足量)时,生成的氢气质量相等,生成等质量的氢气,需要的铁的质量小于锌的质量,故正确;
C.由于盐酸是足量的,等质量的+2价金属和足量的稀盐酸反应时相对原子质量越大,生成氢气的质量越少,铁的相对原子质量小于锌的相对原子质量,要生成等质量的氢气,需要的铁就较少,所以相同质量的锌铁与足量的盐酸反应时,铁生成的氢气多,水平线靠上;但反应开始时两线应该是重合的,故不正确;
D.在高温的条件下,一氧化碳能将氧化铁还原为铁,方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
160 112
所以需加热一段时间后反应才开始,所以开始固体质量不变,随着反应的进行,固体质量减少,当完全反应时,固体的质量不再改变,故正确.
故选BD.
点评 此题是化学反应、及化学实验与图象知识的考查题,要结合反应和实验的过程与图象情况的走势联系起来,这是解题的关键所在.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 氨气 | B. | 氯化钠 | C. | 金刚石 | D. | 硫酸铜 |
| A. | 在水的净化过程中,蒸馏的净化程度最高 | |
| B. | 可用活性炭来区分硬水和软水 | |
| C. | 过滤操作可以除去水中的所以杂质 | |
| D. | 在水的电解实验中,正极产生的是氢气 |
| A. | 含有2个氢分子 | B. | 碳、氢、硫三种元素质量比是4:4:1 | ||
| C. | 完全燃烧后只生成二氧化碳和水 | D. | 碳元素的质量分数最大 |

同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据:
| A | B | C | D | |
| 盐酸加入Na2CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).选择这套装置的原因是反应在密闭容器中进行
A.左盘高 B.右盘高 C.保持平衡
(3)在图2的锥形瓶中添加氢氧化钠的原因是吸收反应生成的二氧化碳,其发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
| A. | 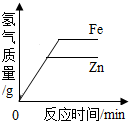 表示等质量的锌和铁分别与足量溶质质量分数相同的稀硫酸反应 | |
| B. | 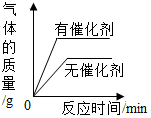 表示完全相同的两份过氧化氢溶液在有、无催化剂条件下的分解 | |
| C. | 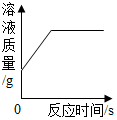 表示向一定量硫酸铜溶液中加入一定量锌粉 | |
| D. | 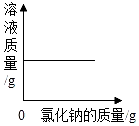 表示向一定量的饱和氯化钠溶液中加入硝酸钾固体 |

 A~I为初中化学中常见物质.已知A为金属氧化物,C为白色沉淀,D为蓝色沉淀,甲为锌粉和铁粉的混合物.(部分生成物末标出),它们之间的关系如图所示.请回答下列问题:
A~I为初中化学中常见物质.已知A为金属氧化物,C为白色沉淀,D为蓝色沉淀,甲为锌粉和铁粉的混合物.(部分生成物末标出),它们之间的关系如图所示.请回答下列问题: