题目内容
12.有一种固体混合物可能由NH4NO3、NaCl、CuSO4、CaCO3、Na2SO4中的一种或几种物质组成,为了测定其组成,进行下列实验:①将固体混合物溶于水后得无色透明澄清溶液A;
②向A中加入足量BaCl2溶液完全反应后,过滤,得白色沉淀X和澄清溶液B;
③白色沉淀X中加入足量盐酸,沉淀不消失;
④澄清溶液B中,加入氢氧化钠溶液并微热,有刺激性气味的气体Y放出.
(1)写出X、Y的化学式:XBaSO4,YNH3.
(2)推断原混合物一定含有的物质是Na2SO4、NH4NO3,一定不含有的物质是CuSO4、CaCO3,可能含有的物质是NaCl.
(3)该实验过程中涉及的化学方程式有(任意写两个):Na2SO4+BaCl2═BaSO4↓+2NaCl,NH4NO3+NaOH=NaNO3+NH3↑+H2O,均属于基本反应类型中的复分解反应.
分析 根据题干提供的信息进行分析解答,①将固体混合物溶于水后得无色透明澄清溶液A,硫酸铜溶液是蓝色的,碳酸钙是不溶于水的物质;
②向A中加入足量BaCl2溶液完全反应后,过滤,得白色沉淀X和澄清溶液B,氯化钡能与硫酸钠反应生成硫酸钡沉淀;
③白色沉淀X中加入足量盐酸,沉淀不消失,硫酸钡不溶于酸;
④澄清溶液B中,加入氢氧化钠溶液并微热,有刺激性气味的气体Y放出,说明含有铵根离子.
据此解答.
解答 解:①将固体混合物溶于水后得无色透明澄清溶液A,硫酸铜溶液是蓝色的,碳酸钙是不溶于水的物质,说明固体这一定不含有硫酸铜和碳酸钙;
②向A中加入足量BaCl2溶液完全反应后,过滤,得白色沉淀X和澄清溶液B,氯化钡能与硫酸钠反应生成硫酸钡沉淀,说明一定含有硫酸钠;
③白色沉淀X中加入足量盐酸,沉淀不消失,硫酸钡不溶于酸;
④澄清溶液B中,加入氢氧化钠溶液并微热,有刺激性气味的气体Y放出,说明含有铵根离子,一定含有硝酸铵.
(1)X是硫酸钡,Y是氨气,故填:BaSO4,NH3;
(2)原混合物一定含有的物质是Na2SO4、NH4NO3,一定不含有的物质是CuSO4、CaCO3,可能含有的物质是NaCl.故填:Na2SO4、NH4NO3;CuSO4、CaCO3;NaCl;
(3)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,硝酸铵能与氢氧化钠反应生成硝酸钠、氨气和水,都属于复分解反应,故填:Na2SO4+BaCl2═BaSO4↓+2NaCl,NH4NO3+NaOH=NaNO3+NH3↑+H2O,复分解反应.
点评 在解此类题时,首先分析题中的现象物质之间的关系,然后根据现象推出可以确定存在或不存在的物质,对于现象不能确定的只能再设计实验进行验证.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$→_{△}^{浓H_{2}SO_{4}}$CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是d(填字母编号).
【问题讨论】用下图所示装置进行实验:
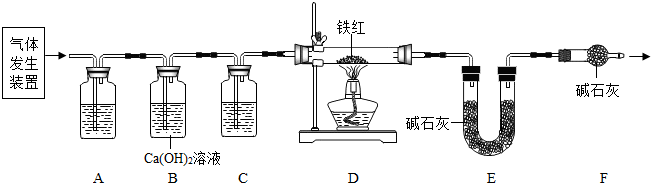
(2)实验前应先检查装置的气密性.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是验证CO2已除尽.
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸. ②停止加热后驱赶装置中滞留的CO2,使其全部被E装置中碱石灰全部吸收.
(6)写出D装置中所发生反应的一个化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数:
(7)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为m g,则7.0<m<7.8.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76%.
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数
会偏小(填“偏小”、“不变”或“偏大”).
反思2:请指出问题讨论中实验装置的一个明显缺陷缺少尾气处理装置或未检验水是否除尽.
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$→_{△}^{浓H_{2}SO_{4}}$CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是d(填字母编号).

【问题讨论】用下图所示装置进行实验:

(2)实验前应先检查装置的气密性.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是验证CO2已除尽.
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸. ②停止加热后驱赶装置中滞留的CO2,使其全部被E装置中碱石灰全部吸收.
(6)写出D装置中所发生反应的一个化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
①D中充分反应后得到Fe粉的质量为m g,则7.0<m<7.8.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76%.
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数
会偏小(填“偏小”、“不变”或“偏大”).
反思2:请指出问题讨论中实验装置的一个明显缺陷缺少尾气处理装置或未检验水是否除尽.
7.水受热变成水蒸气的过程中,下列说法不正确的是( )
| A. | 水分子运动速率加快 | B. | 水分子之间的间隔变大 | ||
| C. | 水分子的数目增多了 | D. | 水分子的结构没有改变 |
1.下列对宏观现象的微观解释正确的是( )
| A. | 稀有气体可做保护气,因为原子最外层电子层达到稳定结构 | |
| B. | 水和过氧化氢的化学性质不同,因为组成元素和分子构成不同 | |
| C. | NaOH溶于水温度升高,因为Na+、OH-扩散吸收的热量大于水合放出的热量 | |
| D. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 |
2.分类是学习化学的方法之一,下列物质归类正确的是( )
| A. | 有机物:石墨、酒精、葡萄糖 | B. | 氧化物:水、氯化铁、五氧化二磷 | ||
| C. | 盐|碳酸钙、纯碱、氯化铵 | D. | 单质:金刚石、氨气、红磷 |
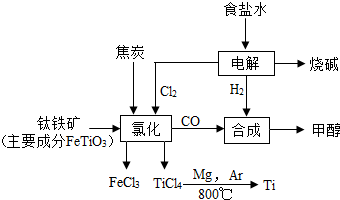 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染.
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染. 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.