题目内容
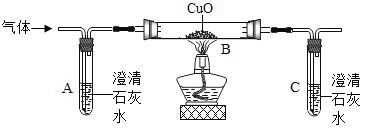
【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各实验,回答下列问题:
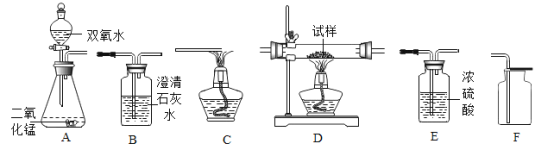
(1)该组欲在实验室中制备并收集干燥的氧气。
①所选仪器的连接顺序为____________(填写仪器序号字母)。
②制取氧气所发生反应的化学方程式为____________________________________。
③氧气在空气中有相对稳定的含量是由于在自然界中存在氧的循环,请写出自然界中消耗氧气的一条途径______________________。
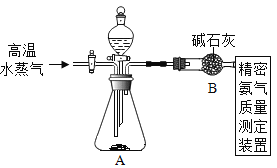
(2)用干燥纯净的氧气对纤维素的组成进行分析探究实验(资料显示纤维素只含C、H、O三种元素)。所选装置按“氧气→D→E→B→碱石灰干燥管”的顺序连接(实验前检查装置的气密性,假设所发生的化学反应都完全充分进行)。装置B中出现的现象为___________,装置D的玻璃管中放入纤维素试样的质量为1.62g,充分反应后,测得装置E的质量增加0.9g,装置B的质量增加2.64g,通过计算可得出纤维素中C、H、O三种元素的质量比为___:___:_____(计算结果用最简整数比表示)。
【答案】AEF  呼吸作用 澄清石灰水变浑浊 36 5 40
呼吸作用 澄清石灰水变浑浊 36 5 40
【解析】
过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气密度比空气大,可以用向上排空气法收集;
浓硫酸具有吸水性,可作氧气的干燥剂;
光合作用生成氧气,呼吸作用消耗氧气;
化学反应遵循质量守恒定律,即反应前后元素种类、原子种类及个数和质量都不变。
(1)
①所选仪器的连接顺序为:通过A制取氧气,通过E干燥氧气,通过F收集氧气。
故填:AEF。
②过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式为: 。
。
③自然界中消耗氧气的一条途径是呼吸作用,呼吸作用过程中消耗氧气,生成二氧化碳等物质。
故填:呼吸作用。
(2)纤维素与氧气在加热时反应生成二氧化碳和水,通过E浓硫酸干燥后进入装置B,B中澄清石灰水遇到二氧化碳要变浑浊;
测得装置E的质量增加0.9g,说明生成了0.9g水,装置B的质量增加2.64g,说明生成了2.64g二氧化碳;
0.9g水中氢元素质量为:![]() ;
;
2.64g二氧化碳中碳元素质量为:2.64g×![]() =0.72g;
=0.72g;
水中的氢元素、二氧化碳中的碳元素都来自于纤维素,故纤维素中碳元素质量是0.72g,氢元素质量是0.1g,纤维素只有三种元素,所以其中氧元素质量就等于纤维素质量减去氢和碳元素的质量,即:1.62g-0.72g-0.1=0.8g,
纤维素中C、H、O三种元素的质量比为:0.72g:0.1g:0.8g=36:5:40,
故填:36;5;40。