题目内容
 牙膏是生活必需品,某兴趣小组对某品牌市售牙膏展开如下探究,请回答问题:
牙膏是生活必需品,某兴趣小组对某品牌市售牙膏展开如下探究,请回答问题:【资料卡片】
a.SiO2不溶于水、且不与酸反应,高温不分解;
b.NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c.牙膏中保湿剂、增稠剂、香精等均为有机物.
(大多数有机物在高温下易燃或分解为气体)
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
【实验步骤】
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀盐酸,至
③过滤、洗涤、称量得到剩余固体质量(如右表);
| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 实验后(g) | 0.43 | 0.44 | 0.45 |
【数据处理】
(4)此测定做3次实验的目的是
(5)综合上述实验方案及实验数据,此牙膏中SiO2的质量分数是
【实验分析】
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是
(7)步骤②中,加稀HCl发生的反应的化学方程式有
(8)步骤③中,洗涤的目的是
(9)为保证洗涤效果,最好用
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
考点:实验探究物质的组成成分以及含量,固体溶解度的影响因素,溶液的酸碱性与pH值的关系,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)从pH为8.3>7,故呈碱性;用pH试纸只能测出整数值,由于牙膏的pH为8.3,中有小数去分析解答;
(2)从冬天温度降低,牙膏中的K12(一种钠盐)析出,说明K12的溶解度变小了去分析解答;
【实验步骤】
②从稀盐酸和CaCO3、NaHCO3两种物质发生反应,前者生成氯化钙、水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;后者生成氯化钠、水和二氧化碳,其化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;二者反应都生成二氧化碳气体,去分析解答;
【数据处理】
(4)从取平均值减小误差去分析解答;
(5)综合上述实验方案及实验数据通过计算去分析解答;
【实验分析】
(6)从由于没有干燥,没有除去SiO2的中的水分,导致测定结果偏大,去分析解答;
(7)从由上面步骤②分析可以得出,加稀HCl发生的反应的化学方程式分别为:CaCO3+2HCl═CaCl2+H2O+CO2↑;NaHCO3+HCl═NaCl+H2O+CO2↑去分析解答;
(8)从过滤后的固体表面有溶液,溶液中含有氯化钠和氯化钙,水分一蒸发,溶质就留在固体里,导致测得SiO2的质量偏大去分析解答;
(9)A、从SiO2不溶于水,蒸馏水是纯净物,氯化钠和氯化钙易溶于水,去分析解答;
B、从由于自来水是混合物,含有其他杂质去分析解答;
C、从氯化钠的饱和溶液不能再溶解氯化钠,无法洗去氯化钠去分析解答;
D、从氯化钙的饱和溶液不能再溶解氯化钙,无法洗去氯化钙去分析解答;
(2)从冬天温度降低,牙膏中的K12(一种钠盐)析出,说明K12的溶解度变小了去分析解答;
【实验步骤】
②从稀盐酸和CaCO3、NaHCO3两种物质发生反应,前者生成氯化钙、水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;后者生成氯化钠、水和二氧化碳,其化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;二者反应都生成二氧化碳气体,去分析解答;
【数据处理】
(4)从取平均值减小误差去分析解答;
(5)综合上述实验方案及实验数据通过计算去分析解答;
【实验分析】
(6)从由于没有干燥,没有除去SiO2的中的水分,导致测定结果偏大,去分析解答;
(7)从由上面步骤②分析可以得出,加稀HCl发生的反应的化学方程式分别为:CaCO3+2HCl═CaCl2+H2O+CO2↑;NaHCO3+HCl═NaCl+H2O+CO2↑去分析解答;
(8)从过滤后的固体表面有溶液,溶液中含有氯化钠和氯化钙,水分一蒸发,溶质就留在固体里,导致测得SiO2的质量偏大去分析解答;
(9)A、从SiO2不溶于水,蒸馏水是纯净物,氯化钠和氯化钙易溶于水,去分析解答;
B、从由于自来水是混合物,含有其他杂质去分析解答;
C、从氯化钠的饱和溶液不能再溶解氯化钠,无法洗去氯化钠去分析解答;
D、从氯化钙的饱和溶液不能再溶解氯化钙,无法洗去氯化钙去分析解答;
解答:解:(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,由于8.3>7,故呈碱性;用pH试纸只能测出整数值,由于牙膏的pH为8.3,中有小数,故用pH试纸测不出;故答案为:碱 否;
(2)冬天温度降低,牙膏中的K12(一种钠盐)析出,说明K12的溶解度变小了;故答案为:溶解度随温度的升高而增大;
【实验步骤】
②由①通过烘干水分,高温加热,至质量不再减轻为止,剩余的物质中主要含有SiO2、CaCO3、NaHCO3三种物质,加入稀盐酸后,CaCO3、NaHCO3两种发生反应,前者生成氯化钙、水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;后者生成氯化钠、水和二氧化碳,其化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;二者反应都生成二氧化碳气体,故当不再产生二氧化碳气体时,表示二者已经完全反应;故答案为:不再产生气体为止;
【数据处理】
(4)为防止一次实验出现偏差,本实验采取做3次实验取平均值的方法;故答案为:减小误差;
(5)综合上述实验方案及实验数据,此牙膏中SiO2的质量分数:SiO2的质量=
=0.44g,质量分数为:
×100%=22%;故答案为:22%;
【实验分析】
(6)按上述实验步骤操作,由于没有干燥,没有除去SiO2的中的水分,导致测定结果偏大,故答案为:剩余固体中含有水分;
(7)由上面步骤②分析可以得出,加稀HCl发生的反应的化学方程式分别为:CaCO3+2HCl═CaCl2+H2O+CO2↑;NaHCO3+HCl═NaCl+H2O+CO2↑;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑ NaHCO3+HCl═NaCl+H2O+CO2↑;
(8)由于过滤后的固体表面有溶液,溶液中含有氯化钠和氯化钙,水分一蒸发,溶质就留在固体里,导致测得SiO2的质量偏大;故答案为:除去固体表面附着的氯化钠、氯化钙溶液 偏大;
(9)由于SiO2不溶于水,氯化钠和氯化钙易溶于水.
A、由于SiO2不溶于水,蒸馏水是纯净物,氯化钠和氯化钙易溶于水,故A正确;
B、由于自来水是混合物,含有其他杂质,故B错误;
C、氯化钠的饱和溶液不能再溶解氯化钠,无法洗去氯化钠;故C错误;
D、氯化钙的饱和溶液不能再溶解氯化钙,无法洗去氯化钙;故D错误;
故答案为:A.
(2)冬天温度降低,牙膏中的K12(一种钠盐)析出,说明K12的溶解度变小了;故答案为:溶解度随温度的升高而增大;
【实验步骤】
②由①通过烘干水分,高温加热,至质量不再减轻为止,剩余的物质中主要含有SiO2、CaCO3、NaHCO3三种物质,加入稀盐酸后,CaCO3、NaHCO3两种发生反应,前者生成氯化钙、水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;后者生成氯化钠、水和二氧化碳,其化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;二者反应都生成二氧化碳气体,故当不再产生二氧化碳气体时,表示二者已经完全反应;故答案为:不再产生气体为止;
【数据处理】
(4)为防止一次实验出现偏差,本实验采取做3次实验取平均值的方法;故答案为:减小误差;
(5)综合上述实验方案及实验数据,此牙膏中SiO2的质量分数:SiO2的质量=
| 0.44+0.43+0.45 |
| 3 |
| 0.44g |
| 2.00g |
【实验分析】
(6)按上述实验步骤操作,由于没有干燥,没有除去SiO2的中的水分,导致测定结果偏大,故答案为:剩余固体中含有水分;
(7)由上面步骤②分析可以得出,加稀HCl发生的反应的化学方程式分别为:CaCO3+2HCl═CaCl2+H2O+CO2↑;NaHCO3+HCl═NaCl+H2O+CO2↑;故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑ NaHCO3+HCl═NaCl+H2O+CO2↑;
(8)由于过滤后的固体表面有溶液,溶液中含有氯化钠和氯化钙,水分一蒸发,溶质就留在固体里,导致测得SiO2的质量偏大;故答案为:除去固体表面附着的氯化钠、氯化钙溶液 偏大;
(9)由于SiO2不溶于水,氯化钠和氯化钙易溶于水.
A、由于SiO2不溶于水,蒸馏水是纯净物,氯化钠和氯化钙易溶于水,故A正确;
B、由于自来水是混合物,含有其他杂质,故B错误;
C、氯化钠的饱和溶液不能再溶解氯化钠,无法洗去氯化钠;故C错误;
D、氯化钙的饱和溶液不能再溶解氯化钙,无法洗去氯化钙;故D错误;
故答案为:A.
点评:注意pH数值上可以有小数,但用pH试纸只能测出整数值.

练习册系列答案
相关题目
你喜欢烹饪吗?高超的烹饪技艺不仅能改善营养,而且能丰富生活情趣.下列烹饪的菜肴中富含油脂的是( )
A、 凉拌黄瓜 凉拌黄瓜 |
B、 红烧肥肉 红烧肥肉 |
C、 玉米窝头 玉米窝头 |
D、 清蒸螃蟹 清蒸螃蟹 |
下列日常生活中的变化,属于物理变化的是( )
| A、菜刀生锈 | B、汽油燃烧 |
| C、冰块融化 | D、粮食酿酒 |
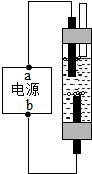 水是生命之源,请回答下列有关水的问题:
水是生命之源,请回答下列有关水的问题:
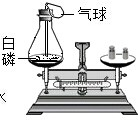 小明用如图所示实验来探究质量守恒定律.反应前天平平衡,他取下此装置(装置气密性良好),将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并马上塞紧瓶塞.待充分反应后,气球膨胀,立即将装置放回天平左盘,此时他发现天平的指针向右偏转了.请问:
小明用如图所示实验来探究质量守恒定律.反应前天平平衡,他取下此装置(装置气密性良好),将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并马上塞紧瓶塞.待充分反应后,气球膨胀,立即将装置放回天平左盘,此时他发现天平的指针向右偏转了.请问: