题目内容
5.请你结合下列装置图回答问题:
(1)仪器①的名称是集气瓶,仪器②的名称是酒精灯.
(2)实验室用A装置来制取氧气,A中盛放的是高锰酸钾,反应的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,小海同学发现A中缺少的一种用品是棉花.用C装置可以制取许多种气体,C装置的气密性检查方法是关闭止水夹,从长颈漏斗中向试管中加水一段时间后在长颈漏斗下端形成一段高于试管中液面的小水柱.
(3)实验室用B装置制取二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,若实验室用碳酸钠与盐酸来制备二氧化碳,用C装置是否合适否(填“是”或“否”),若用G收集二氧化碳,则气体应从b (填b或c)口进气.
(4)实验室常用无水醋酸钠固体与碱石灰共热制甲烷,甲烷是无色、无味、可燃的气体,不易溶于水,则制取并收集干燥的甲烷的装置组合为AE或AG,甲烷在光照条件下能与氯气(Cl2)以分子数1:1发生取代反应生成一氯甲烷(CH3Cl),则另一种产物的化学式为HCl.
分析 集气瓶是收集气体的仪器,酒精灯是常用的加热仪器;C装置的气密性检查方法是:关闭止水夹,从长颈漏斗中向试管中加水一段时间后在长颈漏斗下端形成一段高于试管中液面的小水柱;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室常用无水醋酸钠固体与碱石灰共热制甲烷,因此需要加热;甲烷在光照条件下能与氯气(Cl2)以分子数1:1发生取代反应生成一氯甲烷(CH3Cl)和氯化氢气体.
解答 解:(1)集气瓶是收集气体的仪器,酒精灯是常用的加热仪器,故答案为:集气瓶、酒精灯;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;C装置的气密性检查方法是:关闭止水夹,从长颈漏斗中向试管中加水一段时间后在长颈漏斗下端形成一段高于试管中液面的小水柱;故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;棉花;关闭止水夹,从长颈漏斗中向试管中加水一段时间后在长颈漏斗下端形成一段高于试管中液面的小水柱.
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;若实验室用碳酸钠与盐酸来制备二氧化碳,不能用C装置,因为碳酸钠是粉末;若用G收集二氧化碳,则气体应从长管进入,因为二氧化碳的密度比空气大,故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;否;b;
(4)甲烷在光照条件下能与氯气(Cl2)以分子数1:1发生取代反应生成一氯甲烷(CH3Cl)和氯化氢气体;故答案为:AE或AG(漏选不给分);HCl;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和检查装置的气密性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

(1)地球上各种生物活动所需的能量主要来自于能,绿色植物通过作用将二氧化碳和水转化为葡萄糖和氧气.植物秸秆还可用于发酵制取沼气,沼气主要成分为甲烷.甲烷的化学式为.为减少污染,治理“雾霾“,提高煤的利用率,可将其转化为可燃性气体,相关反应的微观示意图如下所示,该反应生成物的化学计量数之比为1:1
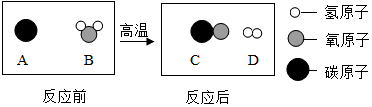
(2)香烟燃烧产生的烟气中含有尼古丁(化学式为C10H14N2)、焦油和CO等有害物质,其中尼古丁属于有机物(填“有机物”、“无机物”),尼古丁中C、H、N三种元素的原子个数最简比为5:7:1.
(3)草木灰的浸出液中含有碳酸钾,向少量浸出液中滴入2滴紫色石蕊试液,溶液呈蓝色,说明草木灰的浸出液显碱性(填“酸”、“碱”、“中”);碳酸钾中阳离子的符号是K+.
(4)快热食品包装袋内部有一夹层,夹层内分开放置生石灰(CaO)、水,使用时将两种物质接触发生化学反应而放出热量,化学方程式可表示为CaO+H2O=Ca(OH)2.
(5)生活中常用到如下日用化工品
| 名称 | 洗洁精 | 炉具清洁剂 | 洁厕灵 | “84”消毒液 |
| 有效成分 | 表面活性剂 | 氢氧化钠 | 盐酸 | 次氯酸钠 |
| A. |  量取液体 | B. |  稀释浓硫酸 | C. |  蒸发食盐水 | D. |  测溶液pH |
| A. | 加碘食盐溶液中加入淀粉,溶液变蓝 | |
| B. | 硫粉在空气中燃烧,产生无色无味气体 | |
| C. | 氯化钡溶液中通入二氧化碳,出现白色沉淀 | |
| D. | 鸡蛋清溶液中滴入饱和硫酸铵溶液,出现白色浑浊 |
 KNO3和NaCl的溶解度表及溶解度曲线如图,下列说法错误的是( )
KNO3和NaCl的溶解度表及溶解度曲线如图,下列说法错误的是( )| 温度/℃ | 0 | 20 | 40 | 60 | 80 | |
| 溶解度 S/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | |
| A. | t1介于20℃-40℃之间 | |
| B. | 50℃时,溶液的溶质质量分数:KNO3>NaCl | |
| C. | 当KNO3中混有少量NaCl时,可用降温结晶的方法提纯 | |
| D. | 60℃时,30g KNO3加入50g水,充分溶解,再降温到20℃,会析出晶体14.2g |
| A. | N5:5个氮原子 | |
| B. | 2O2:2个氧分子 | |
| C. | Zn2+:正二价的锌元素 | |
| D. | 铝与盐酸的反应:Al+2HCl=AlCl2+H2↑ |
| A. | 氧化铜 | B. | 氧气 | C. | 氯化钠 | D. | 金刚石 |
 实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系如图所示′.
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系如图所示′.