题目内容
12.工业上用电解饱和NaCl溶液的方法制烧碱,其反应的化学方程式如下:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑(1)NaOH中钠、氧、氢元素的质量比为23:16:1.
(2)已知20℃时,NaCl的溶解度为36g,其饱和溶液中溶质和溶剂的质量比为9:25.
(3)20℃时,取136g饱和NaCl溶液电解,当NaCl转化了32.5%时,理论上剩余溶液的质量为多少?
分析 (1)根据氢氧化钠的化学式和相对原子质量计算元素质量比;
(2)根据20℃时,NaCl的溶解度为36g进行分析;
(3)根据化学方程式和题中的数据进行计算.
解答 解:(1)NaOH中钠、氧、氢元素的质量比为:23:16:1;
(2)20℃时,NaCl的溶解度为36g,所以饱和溶液中溶质和溶剂的质量比为:36g:100g=9:25;
(3)设生成H2的质量为x,生成Cl2的质量为y
2NaCl+2H2O═2NaOH+H2↑+Cl2↑
2×58.5 2 71
36g×32.5% x y
$\frac{117}{36g×32.5%}$=$\frac{2}{x}$=$\frac{71}{y}$
x=0.2g
y=7.1g
剩余溶液的质量=136g?0.2g?7.1g=128.7g,
答:剩余溶液的质量为128.7g.
故答案为:(1)23:16:1;
(2)9:25;
(3)剩余溶液的质量为128.7g.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
2.碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业.有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如图所示.
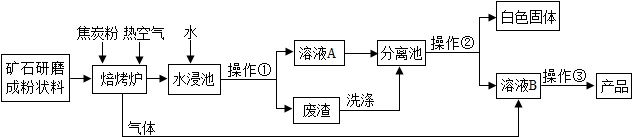
已知:碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应.但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度.
(1)写出焙烧炉中含钡元素物质发生反应的化学方程式:BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑
(2)除了水之外,进入分离池中的物质是氢氧化钡和氢氧化钙,请你推测分离池中操作②的方法是B(选填“A”或“B”).
A.降温,过滤;B.加热,过滤
(3)写出由溶液B制取产品的化学方程式:Ba(OH)2+CO2=BaCO3↓+H2O
(4)以下相关说法正确的是ABD.
A.对矿石进行预处理“研磨成粉状”有利于充分反应
B.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
C.焙烧炉内只涉及分解反应
D.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料.

已知:碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的氢氧化物,这两种氢氧化物均可以和二氧化碳反应.但氢氧化物溶解度有一定的差异,下表所示的是两种氢氧化物在不同温度下的溶解度.
| 温度/℃ | 0 | 40 | 80 |
| Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
| Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
(2)除了水之外,进入分离池中的物质是氢氧化钡和氢氧化钙,请你推测分离池中操作②的方法是B(选填“A”或“B”).
A.降温,过滤;B.加热,过滤
(3)写出由溶液B制取产品的化学方程式:Ba(OH)2+CO2=BaCO3↓+H2O
(4)以下相关说法正确的是ABD.
A.对矿石进行预处理“研磨成粉状”有利于充分反应
B.焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态
C.焙烧炉内只涉及分解反应
D.废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料.
20.下列图示的操作中,不正确的是( )
| A. |  倾倒液体 | B. |  加热液体 | C. |  滴加液体 | D. |  过滤 |
17.下列几种常见的饮料中,不属于溶液的是( )
| A. | 椰子水 | B. | 矿泉水 | C. | 豆浆 | D. | 啤酒 |
4.下列厲于物质物理性质的是( )
| A. | 活性炭有吸附性 | B. | 硫有可燃性 | ||
| C. | 氢氧化钠有腐蚀性 | D. | 碳酸有酸性 |
 纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产.
纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产. 所示.该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备.该酸雾腐蚀金属铁的化学方程式为Fe+2HCl═FeCl2+H2↑.
所示.该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备.该酸雾腐蚀金属铁的化学方程式为Fe+2HCl═FeCl2+H2↑.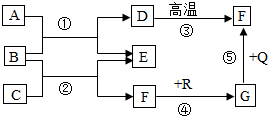 如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去).请回答:
如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去).请回答: