题目内容
19.下列离子的溶液中溶质全部为酸的是( )| A. | H+、Na+、SO42- | B. | H+、Cl-、NO3- | C. | OH-、K+、Ba2+ | D. | Ag+、K+、NO3- |
分析 根据酸的概念进行分析,电离时生成的阳离子全部是氢离子的化合物.
解答 解:酸是电离时生成的阳离子全部是氢离子的化合物..
A、阳离子除了有氢离子外还有钠离子,故错误;
B、阳离子全部是氢离子,故正确;
C、不含有氢离子,故错误;
D、不含有氢离子,故错误;
故选B.
点评 本题主要考查酸的组成,熟悉酸碱盐的定义是解题的关键.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
9. 通过化学学习,应该知道有多种途径可以制取氧气.如:
通过化学学习,应该知道有多种途径可以制取氧气.如:
A.电解水B.分离液态空气 C.加热高锰酸钾D.分解过氧化氢
(1)若用图装置加热氯酸钾制取氧气:
①指出仪器的名称:A试管,B集气瓶;
②实验结束,正确的实验操作步骤是:
先撤导管,后熄灭酒精灯;理由是防止水槽中的水倒流,炸裂试管
反应的文字表达式为氯酸钾$→_{加热}^{二氧化猛}$氯化钾+氧气.
③实验室用氯酸钾制O2,操作有:①点燃酒精灯,加热;②检查装置气密性;③向试管中装入药品;④收集气体;⑤实验完毕后,将导气管从水槽中取出;⑥熄灭酒精灯;⑦将试管固定在铁架台上.正确顺序是②③⑦①④⑤⑥
③图是实验室制备、收集、验满、验证性质的操作,其中正确的是:A

(2)若分解过氧化氢制取氧气,供选用的装置如下:

①要得到平稳的氧气流,应选用的发生装置是B(选填“A”或“B”)
②用D收集氧气,当气泡连续均匀,冒出时,再开始收集;该收集方法叫排水法;
③用过氧化氢制氧气的文字表达式为:过氧化氢$\stackrel{二氧化猛}{→}$水+氧气.
(3)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
①通过实验①和②对比可知,化学反应速率与反应物的浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,反应速率越快;
②用一定量15%的过氧化氢溶液制氧气,为了增加反应速率,可加适量的催化剂,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
 通过化学学习,应该知道有多种途径可以制取氧气.如:
通过化学学习,应该知道有多种途径可以制取氧气.如:A.电解水B.分离液态空气 C.加热高锰酸钾D.分解过氧化氢
(1)若用图装置加热氯酸钾制取氧气:
①指出仪器的名称:A试管,B集气瓶;
②实验结束,正确的实验操作步骤是:
先撤导管,后熄灭酒精灯;理由是防止水槽中的水倒流,炸裂试管
反应的文字表达式为氯酸钾$→_{加热}^{二氧化猛}$氯化钾+氧气.
③实验室用氯酸钾制O2,操作有:①点燃酒精灯,加热;②检查装置气密性;③向试管中装入药品;④收集气体;⑤实验完毕后,将导气管从水槽中取出;⑥熄灭酒精灯;⑦将试管固定在铁架台上.正确顺序是②③⑦①④⑤⑥
③图是实验室制备、收集、验满、验证性质的操作,其中正确的是:A

(2)若分解过氧化氢制取氧气,供选用的装置如下:

①要得到平稳的氧气流,应选用的发生装置是B(选填“A”或“B”)
②用D收集氧气,当气泡连续均匀,冒出时,再开始收集;该收集方法叫排水法;
③用过氧化氢制氧气的文字表达式为:过氧化氢$\stackrel{二氧化猛}{→}$水+氧气.
(3)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验 序号 | 过氧化氢 溶液浓度/% | 过氧化氢 溶液体积/mL | 温度/℃ | 二氧化锰 的用量/g | 收集氧气 的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | / | 2 | 49.21 |
| ④ | 30 | 5 | 55 | / | 2 | 10.76 |
②用一定量15%的过氧化氢溶液制氧气,为了增加反应速率,可加适量的催化剂,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
8.读取量筒中液体体积时,某同学仰视读数为35ml,则实际液体体积为( )
| A. | 大于35ml | B. | 小于35ml | C. | 35ml | D. | 无法判断 |
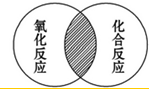 符合图中阴影部分的化学反应的文字表达式的是B
符合图中阴影部分的化学反应的文字表达式的是B
 胃酸的主要成分是盐酸胃酸过多会引起胃疼.如图所示是一种胃病药物的标签.请回答:
胃酸的主要成分是盐酸胃酸过多会引起胃疼.如图所示是一种胃病药物的标签.请回答: