题目内容
18.已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2 等杂质.其提纯流程如图: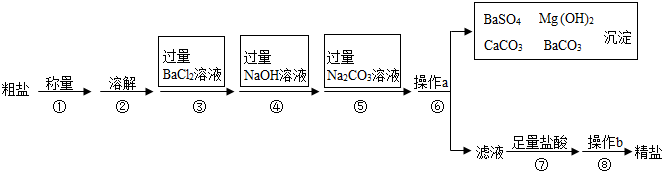
(1)称量粗盐时要使用仪器A,A的名称叫天平.
(2)第④步操作发生反应的化学方程式是2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
(3)第⑤步操作发生反应的化学方程式是BaCl2+Na2CO3=BaCO3↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl.
(4)第⑥步中操作a的名称叫过滤.此步操作中,玻璃棒的末端要轻轻地斜靠在三层滤纸一边.
(5)第⑦步操作滴加足量盐酸发生反应的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O.
(6)第⑧步操作b进行时要用玻璃棒不断搅拌,其作用是防止蒸发时因局部温度过高,造成液滴飞溅.
分析 (1)根据天平可以用来称量固体物质的质量进行分析;
(2)根据氢氧化钠和氯化镁反应会生成氢氧化镁沉淀和氯化钠进行分析;
(3)根据碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,会与反应剩余的氯化钡反应生成碳酸钡沉淀和氯化钠进行分析;
(4)根据过滤是分离不溶性固体和液体的方法,以及过滤操作的注意事项进行分析;
(5)根据盐酸能除去过量的氢氧化钠和碳酸钠进行分析;
(6)根据蒸发操作的注意事项进行分析.
解答 解:(1)天平可以用来称量固体物质的质量,所以称量粗盐时要使用仪器叫天平;
(2)第④步操作发生的反应是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式是:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(3)第⑤步操作发生的反应是碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,会与反应剩余的氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式是:BaCl2+Na2CO3=BaCO3↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)过滤是分离不溶性固体和液体的方法,所以第⑥步中操作a的名称叫过滤,玻璃棒的末端要轻轻地斜靠在三层滤纸一边;
(5)盐酸能除去过量的氢氧化钠和碳酸钠,所以第⑦步操作滴加足量盐酸发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式是:Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O;
(6)第⑧步操作蒸发进行时要用玻璃棒不断搅拌,其作用是防止蒸发时因局部温度过高,造成液滴飞溅.
故答案为:(1)天平;
(2)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(3)BaCl2+Na2CO3=BaCO3↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)过滤,三层滤纸;
(5)Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O;
(6)防止蒸发时因局部温度过高,造成液滴飞溅.
点评 本题考查的是粗盐中可溶性杂质的去除的知识,完成此题,可以依据学过的杂质去除的方法进行.

| A. |  羊毛围巾 | B. |  塑料包装袋 | C. |  玻璃杯 | D. |  木质桌椅 |
| A. | 固体物质在100g水中最多能溶解多少克,它的溶解度就是多少克 | |
| B. | 搅拌、振荡可以加快物质溶解的速率,但不能使它的溶解度增大 | |
| C. | 大部分固体的溶解度与温度成正比 | |
| D. | 固体、气体的溶解度一般都随温度的升高而增大 |
| A. | Na2O2中氧元素化合价为-2价 | B. | R的化学式为CO | ||
| C. | Na2O2的相对分子质量为78 | D. | 碳酸钠俗称小苏打 |
 如图是金属活动性探究实验的一部分,有关该实验的说法中正确的是( )
如图是金属活动性探究实验的一部分,有关该实验的说法中正确的是( )| A. | ①铁片表面无明显变化 | |
| B. | ③溶液逐渐变蓝色 | |
| C. | 通过该实验能得出:金属活动性顺序为:Fe>H>Cu>Ag | |
| D. | ①②或②③都能得出金属活动性顺序为:Fe>Cu>Ag |
【查阅资料】:(1)该固体酒精、氯化钙和氢氧化钠按一定的质量比混合制成的.
(2)氯化钙、氯化钡溶液呈中性.
【提出问题】:固体酒精中的氢氧化钠是否变质?
【实验探究】:(1)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,取沉淀于试管中加稀盐酸,有气泡产生,写出产生气体的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑;
分析实验并结合资料得出氢氧化钠已变质.
(2)为进一步确定氢氧化钠的变质程度,分组探究.
①甲组取烧杯中上层清液于两支试管中,按如图探究.
| 方案 | 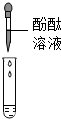 | 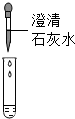 |
| 现象 | 溶液变红 | 产生 白色沉淀 |
| 结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
【实验结论】:经过讨论一致认为固体酒精中氢氧化钠部分变质.
【反思交流】:乙组实验中加足量氯化钡溶液的目的是除去溶液中的Na2CO3,排除其对NaOH检验的干扰.
【拓展应有】:要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的AC(填序号).
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液.
 下列概念符合图关系的是( )
下列概念符合图关系的是( )