题目内容
8.某化学研究性学习小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准备称取25g放于盛有200g稀盐酸(氯化氢的水溶液)的烧杯中(杂质不溶于水,也不与稀盐酸反应,也不分解),恰好完全反应.反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑,反应后烧杯中剩余固体物质共216.2g.试计算:(1)生成二氧化碳的质量是8.8g;
(2)所用稀盐酸的溶质质量分数是多少?
(3)石灰石中碳酸钙的质量分数是多少?
分析 根据质量守恒定律和反应只生成二氧化碳气体可求二氧化碳的质量,进而根据化学方程式求算HCl和碳酸钙的质量,最后求算对应的质量分数.
解答 解:根据质量守恒定律可知,生成的二氧化碳的质量为25g+200g-216.2g=8.8g
设反应掉的HCl的质量为x,碳酸钙的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
y x 8.8g
$\frac{100}{y}$=$\frac{73}{x}$=$\frac{44}{8.8g}$
x=14.6g
y=20g
所用稀盐酸的溶质的质量分数为$\frac{14.6g}{200g}$×100%=7.3%
石灰石中碳酸钙的质量分数为$\frac{20g}{25g}$×100%=80%.
答:(1)生成二氧化碳的质量是 8.8g;
(2)所用稀盐酸的溶质质量分数是7.3%;
(3)石灰石中碳酸钙的质量分数是80%.
点评 首先确定计算所需要用的数据,也就是数据的有效性,其次确定多少未知数待求,所有根据一个化学方程式计算的数据力争一次性全部求算完毕.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
18.我国古代有“女娲补天”的传说,今天,人类也面临“补天”.是指臭氧发生如下变化:3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3,使臭氧层出现空洞,“补天”就是要防止臭氧层出现空洞的形成.下列说法中正确的是( )
| A. | O2和O3都是单质 | B. | O2和O3都是同一种物质 | ||
| C. | O2和O3的性质完全相同 | D. | 该反应是物理变化而不是化学变化 |
19.下列关于实验现象或事实叙述错误的是( )
| A. | 铁丝在氧气中燃烧,火星四射,生成黑色固体 | |
| B. | 切完西瓜的菜刀洗净擦干放在通风干燥处可以防止生锈 | |
| C. | 用黄铜片(铜锌合金)和铜片相互刻画,黄铜片上留有划痕 | |
| D. | 将二氧化碳通入燃着的两支高低蜡烛的烧杯中,蜡烛自低到高依次熄灭 |
20.小明学习金属有关知识后,对“一定金属和盐酸反应快慢的影响因素”进行了探究.
【提出问题】一定金属与盐酸反应快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b.可能与反应时的温度有关.
【设计并进行实验】小明用不同质量分数的盐酸和相同形状的铝片进行如下实验.
【分析数据,得出结论】
(1)写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)通过实验②③对比,说明其他条件相同时,盐酸的浓度越大,反应速率越快;通过实验①③或②④(写编号)对比,说明反应时的温度对反应快慢有影响.
(3)如果盐酸的浓度为10%,温度为25℃,则收集40mL气体所需的时间范围为32s<t<41s.
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是铝片可能没有打磨,实验前没有除去铝表面的氧化膜.
(5)还有哪些因素会影响金属与酸的反应快慢金属的形状(或金属的纯度或反应物的量).
【提出问题】一定金属与盐酸反应快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b.可能与反应时的温度有关.
【设计并进行实验】小明用不同质量分数的盐酸和相同形状的铝片进行如下实验.
| 实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 收集40mL气体所需时间/s |
| ① | 5% | 30 | 48 |
| ② | 10% | 20 | 41 |
| ③ | 5% | 20 | 69 |
| ④ | 10% | 30 | 32 |
(1)写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)通过实验②③对比,说明其他条件相同时,盐酸的浓度越大,反应速率越快;通过实验①③或②④(写编号)对比,说明反应时的温度对反应快慢有影响.
(3)如果盐酸的浓度为10%,温度为25℃,则收集40mL气体所需的时间范围为32s<t<41s.
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是铝片可能没有打磨,实验前没有除去铝表面的氧化膜.
(5)还有哪些因素会影响金属与酸的反应快慢金属的形状(或金属的纯度或反应物的量).
14. 如图为A、B、C三种固体物质的溶解度曲线.下列有关说法正确的是( )
如图为A、B、C三种固体物质的溶解度曲线.下列有关说法正确的是( )
 如图为A、B、C三种固体物质的溶解度曲线.下列有关说法正确的是( )
如图为A、B、C三种固体物质的溶解度曲线.下列有关说法正确的是( )| A. | A的溶解度大于B | |
| B. | t2℃时,A、B溶液的溶质质量分数都是b% | |
| C. | B可能是氯化钠,可用蒸发溶剂的方法从溶液中析出晶体 | |
| D. | 将等质量的A、B、C三种物质的饱和溶液都从t1℃升温到 t2℃,A、B溶液的溶质质量分数相等 |
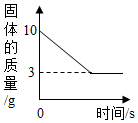 某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:
某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算: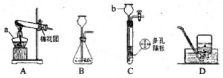 结合图示实验装置,回答下列问题.
结合图示实验装置,回答下列问题.
 如图为用红磷探究质量守恒定律的实验装置图.请完成下列探究过程:
如图为用红磷探究质量守恒定律的实验装置图.请完成下列探究过程: