题目内容
17.实验室用过氧化氢溶液100g与3g二氧化锰制氧气,完全反应后剩余固体混合物质量为99.8g,求原过氧化氢溶液中氢元素的质量.分析 过氧化氢在二氧化锰的催化作用下分解生成水和氧气,过氧化氢中的氢元素完全转化到水中,因此反应后水中的氢元素质量即为原过氧化氢溶液中氢元素的质量.
解答 解:完全反应后水的质量为:99.8g-3g=96.8g,
则原过氧化氢溶液中氢元素的质量为:96.8g×$\frac{2}{18}$×100%≈10.8g,
答:原过氧化氢溶液中氢元素的质量为10.8g.
点评 过氧化氢溶液中氢元素的质量等于溶质过氧化氢中氢元素的质量和溶剂水中氢元素的质量之和,不要漏掉其中之一.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
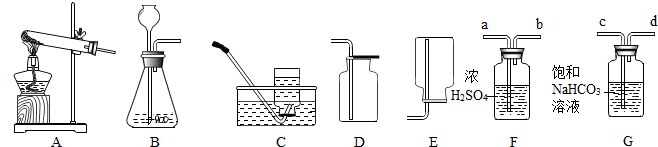
5.某校化学兴趣小组利用下列仪器在实验室进行制取O2的相关实验探究,请回答下列问题.

(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是BE,反应结束后回收MnO2固体,操作依次是冷却至室温、溶解、过滤、洗涤、烘干.
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂.实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
通过比较a和b(填“a”“b”“c”)的大小,可证明Fe2O3在实验中起催化作用,写出该反应的化学方程式2H202$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H20+O2↑.其次需补做实验,验证反应前后Fe2O3的化学性质不变和验证反应前后Fe2O3的质量不变.
(3)丙小组探究MnO2的用量对H2O2分解速率的影响.每次均用30mL10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同):
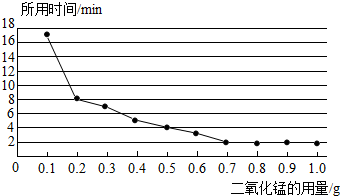
由图可知,MnO2的用量对H2O2分解速率影响的规律是①在一定范围内,MnO2的用量越大,H2O2分解速率越快;
②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快.

(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是BE,反应结束后回收MnO2固体,操作依次是冷却至室温、溶解、过滤、洗涤、烘干.
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂.实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
| 实验序号 | 10%的H2O2 溶液(mL) | 溶液中加入 物质(g) | 收集到气体的 体积(mL) |
| 1 | 100 | 无 | a |
| 2 | 100 | Fe2O30.5g | b |
| 3 | 100 | MnO20.5g | c |
(3)丙小组探究MnO2的用量对H2O2分解速率的影响.每次均用30mL10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同):

由图可知,MnO2的用量对H2O2分解速率影响的规律是①在一定范围内,MnO2的用量越大,H2O2分解速率越快;
②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快.
5.区别下列各组物质,所选择的试剂或方法错误的是( )
| A. | 酒精与水--观察颜色 | B. | 氧气与二氧化碳气体--燃着的木条 | ||
| C. | 水与澄清石灰水--二氧化碳气体 | D. | 空气与氧气--带火星的木条 |
 如图为实验室常用的铁架台示意图.
如图为实验室常用的铁架台示意图. 硝酸钾固体与氯化钾固体的溶解度曲线如图所示,回答下列问题:
硝酸钾固体与氯化钾固体的溶解度曲线如图所示,回答下列问题: 如图所示是某元素的原子结构示意图,该原子在化学反应中容易得电子(填“得”或“失”),所形成粒子的结构示意图为
如图所示是某元素的原子结构示意图,该原子在化学反应中容易得电子(填“得”或“失”),所形成粒子的结构示意图为 ,试写出一种与该元素化学性质相似的元素符号F.
,试写出一种与该元素化学性质相似的元素符号F.