题目内容
3.某学习小组的同学,欲在不使用酸碱指示剂的条件下,通过添加试剂的方法将含有盐酸的氯化钙溶液变为中性.甲同学提出选用石灰石粉末,乙同学提出选用澄清的石灰水.比较甲、乙两同学所选试剂,你认为乙同学的选择不可行;理由是盐酸:该试剂虽然能除去原混合液中的H+,但石灰水显碱性,无法控制溶液正好变为中性.分析 可以根据物质的性质方面进行分析、判断,从而得出正确的结论.例如,用石灰水中和硝酸时,因为两者反应时无明显现象,无法判断是否恰好完全反应.
解答 解:石灰石不溶于水,和盐酸充分反应后不再溶解.石灰水和盐酸是否恰好完全反应不容易判断.
故填乙;盐酸;H+;石灰水显碱性,无法控制溶液正好变为中性.
点评 解答本题的关键是要掌握物质的物理性质和化学性质,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目
14.下列实验现象描述正确的是( )
| A. | 磷在空气中燃烧,有大量白雾生成 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰 | |
| C. | 木炭在空气中燃烧,发出白光 | |
| D. | 铁丝在氧气中燃烧,生成一种黑色的固体四氧化三铁 |
11.下列说法中,不正确的是( )
| A. | 通过闻气味的方法可以鉴别酱油与食醋 | |
| B. | 利用C、CO、H2的还原性来冶炼金属 | |
| C. | 推广使用可降解的塑料制品 | |
| D. | 在猪饲料中添加瘦肉精以满足人们对瘦猪肉的需求 |
18.“绿色化学“要求从根本上消灭污染,它包括“原料的绿色化““化学反应的绿色化““产物的绿色化“等内容.其中“化学反应的绿色化“要求原料物质中所有的原子完全被利用且全部转入期望的产品中.下列符合“化学反应的绿色化“的是( )
| A. | 化工厂用氨、二氧化碳和水制碳酸氢铵:NH3+H2O+CO2=NH4HCO3 | |
| B. | 实验室用石灰石和稀盐酸反应制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O | |
| C. | 氯化铵与消石灰混合研磨产生氨气:2NH4C1+Ca(OH)2=CaCl2+2NH3↑+2H2O | |
| D. | 氢化钙(CaH2)与水反应可以得到氢气:CaH2+2H2O=Ca(OH)2+2H2↑ |
12.如图是初中化学中实验室制取气体的两种基本装置和三种常用的收集方法,请比较装置A和装置B的差异:


| 装置A | 装置B | |
| 反应状态 | 固体反应生成气体 | 固体和液体反应生成气体 |
| 反应条件 | 加热 | 无需加热 |
13.体育课上同学们在做引体向上时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.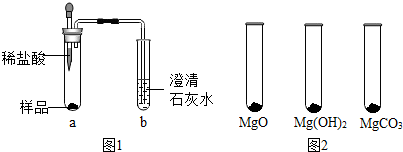
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为Mg(OH)2+2HCl═MgCl2+2H2O.
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.