题目内容
取锌、铜的混合物8g与154.7g稀硫酸恰好完全反应,称得剩余物质的总质量为162.5g。
请计算:
(1)产生氢气的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
、解:设:略
(1)H2的质量是 154.7 g +8g-162.5 =0.2g … …………………… 1分
…………………… 1分
Zn + H2SO4===ZnSO4+ H2↑ ……………………………… ………… 1分
65 161 2
X Y 0.2g
 65 X
65 X
2 0.2g
X = 6.5g ……………………………………………… 1分
 161 Y
161 Y
2 0.2g
Y = 16.1g …… ………………………………………… …… 1分
(2)所得溶液的质量为:
6.5g+154.7g-0.2g=161g 或162.5g-(8g-6.5g)=161g …… …… 1分

所得溶液中溶质的质量分数为 =10% …… … ……… 1分
……… 1分
答:略。(单位和百分号都不在扣分范围内)

 字词句段篇系列答案
字词句段篇系列答案下图为某品牌钙片的部分说明:计算并回答
(1)食用此钙片的成人每天从钙片中补充钙元素 g。
(2)此钙片中含碳酸钙的质量分数为 。
|
根据下列实验目的,所选试剂及操作方法都正确的是
| 选项 | 实验目的 | 所选试剂及操作方法 |
| A | 除去二氧化 | 通入氧气、点燃 |
| B | 除去氯化钾中的二氧化锰 | 加水溶解、过滤、蒸发 |
| C | 除去氧化钙中的碳酸钙 | 加水溶解、过滤 |
| D | 除去稀盐酸中的稀硫酸 | 加入足量的氢氧化钡溶液、过滤 |
下列不属于人体必需的微量元素是( )
|
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 氟 |
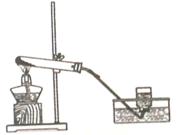 实验室用如图所示的装
实验室用如图所示的装



