题目内容
17.小红同学在实验室中将16g的高锰酸钾放在试管中加热一段时间后,冷却,称得剩余物质的质量为14.4g.(1)大家纷纷猜想所得固体物质的成分(写物质的化学式):
猜想一:K2MnO4、MnO2
猜想二:KMnO4、K2MnO4、MnO2
(2)请通过计算参加反应的高锰酸钾质量来确定哪一种猜想是正确的.猜想二正确.
分析 高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气质量可以计算反应的高锰酸钾质量,进一步可以确定所得固体物质的成分.
解答 解:(1)如果高锰酸钾完全反应,则所得固体物质的成分是K2MnO4、MnO2;
如果高锰酸钾没有完全反应,则所得固体物质的成分是KMnO4、K2MnO4、MnO2.
故填:K2MnO4、MnO2;KMnO4、K2MnO4、MnO2.
(2)设反应的高锰酸钾质量为x,
反应生成氧气质量为:16g-14.4g=1.6g,
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
316 32
x 1.6g
$\frac{316}{x}$=$\frac{32}{1.6g}$,
x=15.8g,
因此高锰酸钾没有完全反应,即所得固体物质的成分有KMnO4、K2MnO4、MnO2.
故填:猜想二正确.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.如图实验操作中,正确的是( )
| A. |  熄灭酒精灯 | B. |  取用液体 | C. |  过滤 | D. |  取用固体 |
5.下列说法中,正确的是( )
| A. | 用10mL量筒量取5.26mL蒸馏水 | |
| B. | 用托盘天平称取11.7gCuO粉末 | |
| C. | 用50mL烧杯量取20mL水 | |
| D. | 用广泛pH试纸测得硫酸溶液的pH为3.5 |
9. 分别把充满甲、乙、丙气体的试管倒插入盛有水的烧杯中,一段时间后,观察到如图所示的现象.下列对甲、乙、丙气体的分析正确的是( )
分别把充满甲、乙、丙气体的试管倒插入盛有水的烧杯中,一段时间后,观察到如图所示的现象.下列对甲、乙、丙气体的分析正确的是( )
 分别把充满甲、乙、丙气体的试管倒插入盛有水的烧杯中,一段时间后,观察到如图所示的现象.下列对甲、乙、丙气体的分析正确的是( )
分别把充满甲、乙、丙气体的试管倒插入盛有水的烧杯中,一段时间后,观察到如图所示的现象.下列对甲、乙、丙气体的分析正确的是( )| A. | 甲、乙、丙气体都易溶于水 | B. | 乙气体比甲气体更易溶于水 | ||
| C. | 可以采用排水法收集丙气体 | D. | 不可用排空气方法收集甲气体 |
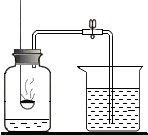 用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?
用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?