题目内容
5.烧杯中有2g石灰石样品,将20g稀盐酸分四次加入烧杯中,加入稀盐酸的质量与剩余固体质量如下表:| 第一次 | 第二次 | 第三次 | 第四次 | |
| 盐酸的质量/g | 5 | 5 | 5 | 5 |
| 剩余的固体/g | 1.4 | m | 0.6 | 0.6 |
(2)石灰石中碳酸钙的质量分数是70%
(3)这些石灰石可以制取多少CO2?(写出计算过程)
分析 (1)根据表中的数据,第1次盐酸和碳酸钙反应,酸完全反应,固体剩余,则5克的盐酸恰好能反应掉(2-1.4)=0.6克碳酸钙,则第2次加盐酸时剩余固体的质量为(1.4-0.6)=0.8克;
(2)第3次再加10克酸时还可溶解0.6克碳酸钙,而剩余固体0.6克,说明碳酸钙不足,剩余固体为杂质,且杂质质量为0.6克,可利用杂质质量和总质量求算;
(3)利用化学方程式计算.
解答 解:(1)因为第1次盐酸和碳酸钙反应,酸完全反应,固体剩余,则5克的盐酸恰好能反应掉(2-1.4)=0.6克碳酸钙,则第2次加盐酸时剩余固体的质量为(1.4-0.6)=0.8克,故答案为:0.8;
(2)碳酸钙的质量分数为:$\frac{2g-0.6g}{2g}$×100%=70%
(3)设这些石灰石可以制取二氧化碳的质量为X
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
2g-0.6g x
$\frac{100}{2g-0.6g}=\frac{44}{x}$
x=0.616g
答案:
(1)0.8;
(2)70%
(3)这些石灰石可以制取二氧化碳的质量为0.616g.
点评 本题考查学生对于数据分析及有关化学方程式的计算,注意计算格式的规范化.

碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。

甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 | 观察到的现象 | 获得结论 | 反应的化学方程式 |
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | _______ | 黑色粉末均为氧化铜 | _______ |
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:

资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 | 反应后 |
玻璃管和内盛氧化铜 粉末的总质量为62.0 g | 玻璃管和内盛红色 粉末的总质量为61.7 g |
玻璃管的质量为60.0 g | |
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______

| A. | 该反应是置换反应 | B. | 生成的两种分子个数比为1:1 | ||
| C. | 反应中有元素化合价发生改变 | D. | 原子在化学变化中可以再分 |
 2014年8月2日,江苏省昆山市一金属制品厂的抛光车间发生了粉尘爆炸,导致75人死185人伤的悲剧,粉尘爆炸是可燃性粉尘在空气中达到一定浓度(称为爆炸极限)后,遇火发生剧烈燃烧产生的爆炸,以下说法或做法错误的是( )
2014年8月2日,江苏省昆山市一金属制品厂的抛光车间发生了粉尘爆炸,导致75人死185人伤的悲剧,粉尘爆炸是可燃性粉尘在空气中达到一定浓度(称为爆炸极限)后,遇火发生剧烈燃烧产生的爆炸,以下说法或做法错误的是( )| A. | 产生粉尘的车间必须注意通风排气 | |
| B. | 在容易产生粉尘的生产车间周围张贴图标 | |
| C. | 粉尘爆炸满足了物质燃烧的三个条件 | |
| D. | 铁在空气中不能点燃,因此,铁产生的粉尘不会爆炸 |

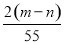 B.
B.  C.
C.  D.
D. 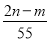
 CO2 表示的意义,叙述错误的是 ( )
CO2 表示的意义,叙述错误的是 ( )