题目内容
实验是实现科学探究的重要途径.请回答以下有关问题:
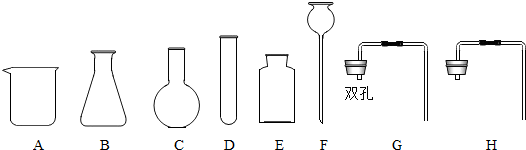
(1)实验室现有下列试剂和仪器:①氯酸钾②碳酸钙粉末③块状碳酸钙固体④稀盐酸⑤稀硫酸⑥浓盐酸
某小组同学利用所给仪器和试剂来制取气体,若选试剂 (填试剂编号),则制取该气体的发生装置和收集装置可选择 (填仪器编号)组装,该组合还可以用来制取 气体,还需补充的试剂是 (填试剂名称).
(2)实验室还可用氯化钠固体与浓硫酸在加热的条件下发生复分解反应,制取氯化氢气体,总反应的方程式为2NaCl+H2SO4(浓)
Na2SO4+2HCl↑.
①上述反应在不加热或微加热条件下,生成硫酸氢钠,而加热到500℃-600℃时就生成硫酸钠,请写出生成硫酸氢钠的化学方程式 ;
②此反应表明,统一反应,当反应条件不同时,所得到的生成物可以不同,结合学过的知识,请举出符合这个要求的另一个例子 ;
(3)另一小组同学为了测定氯酸钾样品的纯度,取5g氯酸钾样品和1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录数据如表:求样品中氯酸钾的质量分数是多少?

(1)实验室现有下列试剂和仪器:①氯酸钾②碳酸钙粉末③块状碳酸钙固体④稀盐酸⑤稀硫酸⑥浓盐酸
某小组同学利用所给仪器和试剂来制取气体,若选试剂
(2)实验室还可用氯化钠固体与浓硫酸在加热的条件下发生复分解反应,制取氯化氢气体,总反应的方程式为2NaCl+H2SO4(浓)
| ||
①上述反应在不加热或微加热条件下,生成硫酸氢钠,而加热到500℃-600℃时就生成硫酸钠,请写出生成硫酸氢钠的化学方程式
②此反应表明,统一反应,当反应条件不同时,所得到的生成物可以不同,结合学过的知识,请举出符合这个要求的另一个例子
(3)另一小组同学为了测定氯酸钾样品的纯度,取5g氯酸钾样品和1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录数据如表:求样品中氯酸钾的质量分数是多少?
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化
分析:(1)根据实验室制取氧气和二氧化碳的原理来选择反生装置和收集装置;
(2)根据反应条件和反应产物正确书写出化学方程式;碳在氧气中燃烧,氧气充足时生成二氧化碳,不充足时生成一氧化碳;
(3)当固体不再减少时,说明完全反应,根据质量守恒定律固体减少的质量就是生成氧气的质量;由氧气的质量根据氯酸钾分解的化学方程式可以计算出样品中氯酸钾的质量分数.
(2)根据反应条件和反应产物正确书写出化学方程式;碳在氧气中燃烧,氧气充足时生成二氧化碳,不充足时生成一氧化碳;
(3)当固体不再减少时,说明完全反应,根据质量守恒定律固体减少的质量就是生成氧气的质量;由氧气的质量根据氯酸钾分解的化学方程式可以计算出样品中氯酸钾的质量分数.
解答:解:(1)实验室制取用块状碳酸钙固体和稀硫酸反应来制取二氧化碳,二氧化碳能溶于水密度比空气大,故选择BHE或CHE 或BEFG或 CEFG组装反生装置和收集装置;该组合还可以适用于二氧化锰和过氧化氢溶液来制取氧气;
(2)①生成硫酸氢钠的化学方程式:NaCl+H2SO4(浓)
NaHSO4+HCl↑;②碳在氧气中燃烧,氧气充足时生成二氧化碳,不充足时生成一氧化碳;
(3)解:生成氧气的质量为:5g+1g-4.08g=1.92g
设KClO3的质量为x
2 KClO3
2KCl+3O2↑
245 96
x 1.92g
245
=
解得:x=4.9g
∴样品中氯酸钾的质量分数为
×100%=98%
答:样品中氯酸钾的质量分数为98%;
答案:(1)③④;BHE或CHE 或BEFG或 CEFG;O2;二氧化锰.过氧化氢溶液;
(2)①NaCl+H2SO4(浓)
NaHSO4+HCl↑;
②碳在氧气中燃烧,氧气充足时生成二氧化碳,不充足时生成一氧化碳;
(3)98%.
(2)①生成硫酸氢钠的化学方程式:NaCl+H2SO4(浓)
| ||
(3)解:生成氧气的质量为:5g+1g-4.08g=1.92g
设KClO3的质量为x
2 KClO3
| ||
| △ |
245 96
x 1.92g
245
| 245 |
| x |
| 96 |
| 1.92g |
解得:x=4.9g
∴样品中氯酸钾的质量分数为
| 4.9g |
| 5g |
答:样品中氯酸钾的质量分数为98%;
答案:(1)③④;BHE或CHE 或BEFG或 CEFG;O2;二氧化锰.过氧化氢溶液;
(2)①NaCl+H2SO4(浓)
| ||
②碳在氧气中燃烧,氧气充足时生成二氧化碳,不充足时生成一氧化碳;
(3)98%.
点评:根据实验室制取氧气和二氧化碳的原理来选择反生装置和收集装置,还考查质量守恒定律和含杂质物质的化学方程式的计算,难度不大关键是对剩余固体的讨论,找到氯酸钾完全反应的状态.

练习册系列答案
相关题目
 如图甲、乙所示是镁元素在元素周期表中的信息和镁原子的结构示意图,根据图示回答:
如图甲、乙所示是镁元素在元素周期表中的信息和镁原子的结构示意图,根据图示回答: “2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.
“2014青岛世园会”于4月25日正式开园,主题是“让生活走进自然”,倡导人与自然和谐相处的绿色发展理念.

 南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.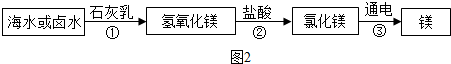

 和
和 分别表示两种不同质子的原子.
分别表示两种不同质子的原子.