题目内容
3.用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平.锌片、铁片、镁片.5%盐酸、20%盐酸.(一)不同金属与酸反应的快慢不同取质量相等的上述两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如图1所示.
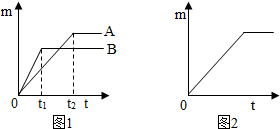
(1)金属活动性顺序表(填元素符号)
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
(2)线B对应的金属为Zn.
(3)线A对应的金属与稀盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑.
(二)金属与不同质量分数的盐酸反应的快慢不同取质量相等的锌片,分别放入5%、20%的足量稀盐酸中.
生成氢气的质量为m,反应时间为t.5%的盐酸与锌片反应m与t的关系曲线如图2所示.请在该图上补画出20%的盐酸与锌片反应m与t的关系曲线.
实验表明,盐酸质量分数越大,与金属反应的速率越快.
(三)温度对金属与盐酸反应速率也有影响
取两个烧杯,分别加入等质量的同种(“同种”、“不同种”)金属,再分别加入足量的质量分数相同(“相同”、“不相同”)的稀盐酸…实验表明,温度越高,盐酸与金属反应的速率越快.
分析 (一)(1)根据金属活动性顺序的记忆情况填写即可;
(2)可从反应速率和氢气生成量两的方面来判断,镁、锌的反应速率要比铁快,由关系式计算可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气,镁反应最快生成氢气最多;锌反应比铁快生成氢气最少;铁反反应最慢生成氢气量居中;
(3)B线对应的金属为Zn那么A线比B线反应慢,生成氢气质量比锌多应为铁,从可写化学方程式;
(二)反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快;
(三)温度、反应物浓度、催化剂、反应物接触面积等都会影响化学反应速率,要研究一种条件对化学反应的影响,就要保持其它条件不变.
解答 解:(一)(1)根据金属活动性顺序可填:Mg、Al、Zn、Fe.
(2)A是活泼性较弱的金属,如果是铁,则B是锌时正好符合图中信息.故填:Zn.
(3)铁与稀盐酸反应生成氯化亚铁和氢气,故填:Fe+2HCl=FeCl2+H2↑
(二)反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快,且由于反应中所取锌片质量相同,所以生成的氢气质量相同,容易画出曲线如图:
(三)温度、反应物浓度、催化剂、反应物接触面积等都会影响化学反应速率,要研究一种条件对化学反应的影响,就要保持其它条件不变,故答案应为:相同、相同.
点评 本题主要考查了化学方程式的书写、图象的画法及其金属活动性顺序等方面的内容,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
11.使用下列金属制品时,主要利用金属导热性的是( )
| A. |  铁钳 | B. |  铁锅 | C. |  水龙头 | D. |  餐刀,汤匙 |
8.下列化学方程式书写正确的是( )
| A. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | B. | 2Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2AlO3 | ||
| C. | CO2+Ca(OH)2═CaCO3↓+H2O | D. | CO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
15.碘[I2]属于( )
| A. | 金属单质 | B. | 非金属单质 | C. | 化合物 | D. | 混合物 |
 ,A元素在化学反应中容易得电子变成阴离子,属非金属元素(填“金属”或“非金属”);B元素的离子结构示意图为:
,A元素在化学反应中容易得电子变成阴离子,属非金属元素(填“金属”或“非金属”);B元素的离子结构示意图为: ,该离子带3个单位正电荷,该元素的原子核外总共有13个电子.A、B元素形成化合物的化学式(用A、B表示)为BA3.
,该离子带3个单位正电荷,该元素的原子核外总共有13个电子.A、B元素形成化合物的化学式(用A、B表示)为BA3.