题目内容
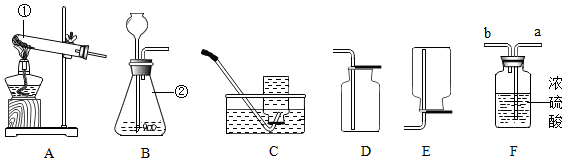
14.实验创新是中学生最为重要的科学素养.如图是小明对MnO2催化H2O2分解的实验装置的创新设计,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取4mL(密度为lg/mL)质量分数为8.5%的H2O2,加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在于燥管的管壁上.
②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象.
(1)可观察到带火星的棒香立即复燃,氧气在棒香燃烧时起到了作用.
(2)假定上述实验中的H2O2完全反应,可产生氧气的质量为0.16g.
分析 根据氧气的性质以及化学方程式和题干提供的数据进行分析解答即可.
解答 解:(1)氧气能使带火星的棒香复燃,故填:复燃;
(2)过氧化氢的质量为:4mL×1g/mL×8.5%=0.34g
设生成氧气的质量为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
0.34g x
$\frac{68}{32}=\frac{0.34g}{x}$
x=0.16g
故填:0.16.
点评 本题考查的是根据化学方程式的计算的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
19.空气是一种重要的天然资源,在生产和生活中有着广泛的用途.下列说法错误的是( )
| A. | 氮气是制造化肥、炸药的重要原料 | B. | 液氧可以作为火箭发动机的燃料 | ||
| C. | 固态二氧化碳可用作人工降雨 | D. | 稀有气体常用作保护气 |
6.实验室制取氧气时,取MnO2和KClO3的固体混合物15.25克,加热至不再产生气体为止.将加热后的剩余物冷却,加10克水充分溶解后,测得剩余固体的质量为7.25克;再在剩余固体中三次分别用10克水充分溶解后,测得剩余固体的质量;数MnO2据记录如下表.(提示:MnO2粉末不溶于水,该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
(1)该实验中MnO2的作用是催化作用.
(2)求实验所制得的氧气的质量(写出具体计算过程).
(3)表中m值为3;理由是由1和2可知加入10g水最多溶解7.25g-4.05g=3.2gKCl,而第三、第四次加水后溶解KCl为4.05g-3g<3.2g,则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2.
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(克) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(克) | 7.25 | 4.05 | m | 3 |
(2)求实验所制得的氧气的质量(写出具体计算过程).
(3)表中m值为3;理由是由1和2可知加入10g水最多溶解7.25g-4.05g=3.2gKCl,而第三、第四次加水后溶解KCl为4.05g-3g<3.2g,则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2.
12.为减少污染、提高煤的利用率,可将其转化为可燃性气体,其微观示意图如下所示:
下列说法正确的是( )

下列说法正确的是( )
| A. | 图中表示化合物的是“ ” ” | |
| B. | 该反应中碳元素化合价升高 | |
| C. | 该反应中反应物两种分子的个数比为3:1 | |
| D. | 反应前后分子数目不变 |