题目内容
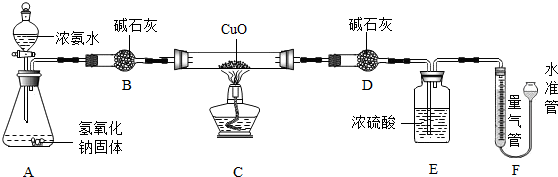
9. 在实验室中,同学们用如图装置制取纯净的CO2,下列说法正确的是( )
在实验室中,同学们用如图装置制取纯净的CO2,下列说法正确的是( )(提示:饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2)
| A. | Ⅰ中固体反应物是大理石,液体反应物是稀H2SO4 | |
| B. | Ⅱ中液体是浓H2SO4,其作用是吸收CO2气体中混有的H2O | |
| C. | Ⅱ中的试剂是饱和碳酸氢钠溶液、Ⅲ中没有白色沉淀,说明CO2气体中已经不含HCl | |
| D. | 若用Ⅴ装置收集CO2气体,应从b端进气 |
分析 A、根据大理石和稀硫酸反应生成的硫酸钙是微溶于水的,覆盖在碳酸钙的表面,阻止了碳酸钙与稀硫酸的进一步接触,使反应停止去分析解答;
B、根据要得到纯净的二氧化碳,应先通过饱和碳酸氢钠溶液除去氯化氢气体,再干燥进行解答;
C、根据氯化氢气体溶于水形成盐酸,盐酸可以和硝酸银反应生成不溶于水的氯化银沉淀去分析解答;
D、根据二氧化碳的密度比空气大,应从长管进气进行分析解答.
解答 解:A、大理石和稀硫酸反应生成的硫酸钙是微溶于水的,覆盖在碳酸钙的表面,阻止了碳酸钙与稀硫酸的进一步接触,使反应停止,因此制取二氧化碳用盐酸,而非硫酸,故A错误;
B、要得到纯净的二氧化碳,应先通过饱和碳酸氢钠溶液除去氯化氢气体,再利用浓硫酸干燥,故Ⅱ中液体是饱和的碳酸氢钠溶液,用来吸收氯化氢气体,故B错误;
C、氯化氢气体溶于水形成盐酸,盐酸可以和硝酸银反应生成不溶于水的氯化银沉淀,由于Ⅲ中没有白色沉淀产生,则说明气体中已经不含有HCl气体,故C正确;
D、由于二氧化碳的密度比空气大,故应从长管进气,将空气挤压到集气瓶上部排出,故D错误;
故选:C.
点评 本题考查了实验室制取二氧化碳的原理、收集方法及除杂等,是中考的重点,应先除杂再检验是否除尽,然后干燥收集.

练习册系列答案
相关题目
20.化学兴趣小组的同学在老师的指导下,开展如下探究活动.
探究一:A、B、C、D分别是纯碱、烧碱、氯化钠、硫酸钠中的一种,它们之间的转化关系如图1所示.
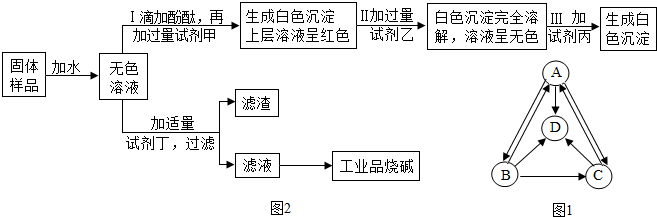
(1)四种物质中,属于碱的是NaOH(填化学式,下同).
(2)物质B是Na2CO3.
探究二:工业品烧碱含有少量氯化钠杂质.该小组同学从一瓶久置的工业品烧碱样品中取出一定量,在烧杯中加适量水溶解后得到样品溶液.用稀硫酸与样品溶液做中和反应实验.有关实验操作和现象如下:
该小组同学对于实验所得红色溶液很感兴趣,展开讨论.溶液里的中和反应是否已经完成?一部分同学认为还没有完成,理由是操作Ⅱ后“溶液仍呈红色”;而另一部分同学则认为中和反应已经完成.结果经过师生共同讨论,确认溶液里中和反应已经完成.
(3)样品溶液的pH>7(填写“<、=或>”).
(4)确认溶液里中和反应已经完成所依据的现象是滴加一定量稀硫酸后溶液中开始产生气泡.
最后,他们设计一个实验方案,验证了久置的工业品烧碱样品中确实含有氯化钠杂质且已经部分变质,并提纯工业品烧碱.其实验流程及部分实验现象如图2所示.
(5)试剂甲和试剂乙的溶液中阴离子都是NO3-(填离子符号).
(6)试剂丁是Ca(OH)2(填化学式).
(7)证明工业品烧碱样品已经部分变质的证据是操作中加过量Ba(NO3)2后生成白色沉淀,上层清液仍呈红色.
探究一:A、B、C、D分别是纯碱、烧碱、氯化钠、硫酸钠中的一种,它们之间的转化关系如图1所示.

(1)四种物质中,属于碱的是NaOH(填化学式,下同).
(2)物质B是Na2CO3.
探究二:工业品烧碱含有少量氯化钠杂质.该小组同学从一瓶久置的工业品烧碱样品中取出一定量,在烧杯中加适量水溶解后得到样品溶液.用稀硫酸与样品溶液做中和反应实验.有关实验操作和现象如下:
| 实验步骤 | 实验现象 |
| Ⅰ.向样品溶液中滴加酚酞溶液 | 溶液呈红色 |
| Ⅱ.向样品溶液中滴加稀硫酸, 并用玻璃棒搅拌 | 滴加一定量稀硫酸后溶液中开始产生气泡 溶液仍呈红色 |
(3)样品溶液的pH>7(填写“<、=或>”).
(4)确认溶液里中和反应已经完成所依据的现象是滴加一定量稀硫酸后溶液中开始产生气泡.
最后,他们设计一个实验方案,验证了久置的工业品烧碱样品中确实含有氯化钠杂质且已经部分变质,并提纯工业品烧碱.其实验流程及部分实验现象如图2所示.
(5)试剂甲和试剂乙的溶液中阴离子都是NO3-(填离子符号).
(6)试剂丁是Ca(OH)2(填化学式).
(7)证明工业品烧碱样品已经部分变质的证据是操作中加过量Ba(NO3)2后生成白色沉淀,上层清液仍呈红色.
19.科学家正在积极探索利用太阳能分解水来获得氢能源,以解决人类面临的能源危机,从化学反应的基本类型分析,该反应是( )
| A. | 分解反应 | B. | 化合反应 | C. | 置换反应 | D. | 复分解反应 |

 2012年4月15日,央视《每周质量报告》报道了部分药品生产企业使用铬超标胶囊生产药品的问题.铬虽然是人体必需的一种微量元素,但过量的摄入会对人体造成危害,影响人体的抗氧化系统,溶液得糖尿病、高血压、肿瘤等多种疾病.请回答下列问题:
2012年4月15日,央视《每周质量报告》报道了部分药品生产企业使用铬超标胶囊生产药品的问题.铬虽然是人体必需的一种微量元素,但过量的摄入会对人体造成危害,影响人体的抗氧化系统,溶液得糖尿病、高血压、肿瘤等多种疾病.请回答下列问题: